
二乙酸一1,4一环己二醇酯是一种重要的化工原料,它可通过下列路线合成:
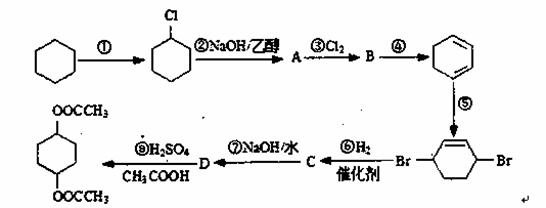
(1)已知反应①的反应物是环己烷与氯气,则该反应的反应条件主要为 。
(2)反应②的反应类型是 。反应⑤的反应类型是 ,该反应的反应物除路线中已给出的有机物外,还有 (填化学式)。
(3)有机物B的结构简式是 。C的结构简式是 。
(4)反应⑧的化学方程式为 。
科目:高中化学 来源: 题型:
下列关于钠及其化合物的叙述,正确的是( )
A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B.氧化钠可用于呼吸面具中作为氧气的来源
C.碳酸钠的水溶液呈中性
D.硫酸钠灼烧时火焰呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
对于右图的锌锰电池,下列说法正确的是
A.MnO2是氧化剂,被氧化
B.碳棒为正极、锌筒为负极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-==Zn(OH)2

查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应的实验,能够达到实验目的的是


A.实验室制取少量的硝基苯 B.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯

C.分离乙酸乙酯、碳酸钠和水的混合物 D.在实验室测定中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = +28.7 kJ·mol-1
= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = -28.7 kJ·mol-1
= -28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) 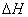 = +57.4 kJ·mol-1
= +57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) 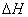 = -57.4 kJ·mol-1
= -57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.氢化铵的电子式: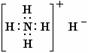 B.甲醇分子的球棍模型:
B.甲醇分子的球棍模型: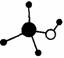
C.次氯酸分子的结构式: D.Ge原子结构示意图:
D.Ge原子结构示意图: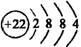
查看答案和解析>>
科目:高中化学 来源: 题型:
试运用所学知识,回答下列问题:
(1)已知某反应的平衡表达式为: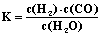 ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)已知在400℃时,N2 (g)+ 3H2(g) 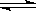 2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g) 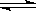 2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L—1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
 ②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
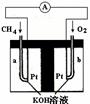
(4)以天然气(假设杂质不参与反应) 为原料的燃料电池示意图如图所示。
为原料的燃料电池示意图如图所示。
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
查看答案和解析>>
科目:高中化学 来源: 题型:
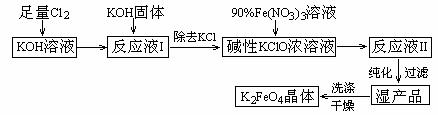
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为
 1.47 g/mL),它的物质的量浓度为 ;
1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I ”中加KOH固体的目的是① ,
② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相对分子质量为100的烃完全燃烧后,生成CO2和H2O的物质的量之比以及分子结构中有四个甲基的同分异构体的数目分别是
A.6:7和2 B.6:7和3 C.7:8和3 D. 7:8和4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com