
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br一、SO42一、Cl一等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:

请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是 。
(2)参照下图溶解度曲线,得到的固体A的主要成分是 (填化学式)。

(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
|
化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
【设计除杂过程】

a、已知试剂B是K2CO3溶液,则溶液A的主要成分是 (填化学式)。
【获取纯净氯化钾】
b、对溶液B加热并不断滴加l mol· L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体时,停止加热。
【问题讨论】
c、进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
(1)分液漏斗 (2)MgSO4
(3)a、Ba(OH)2 b、除去未反应的OH-和CO32- c、1.6×10-7mol/L
【解析】
试题分析:(1)加入氧化剂将Br一变为Br2,加入的CCl4作萃取剂,将溶液中的Br2提取出来,则操作①②分别是萃取、分液,所用主要仪器是分液漏斗、烧杯;(2)操作③④分别是蒸馏或分馏、趁热过滤,根据溶解度曲线,只有MgSO4的溶解度随温度升高而逐渐减小,因此固体A是MgSO4,而MgCl2、KCl固体都需要蒸发浓缩、冷却结晶才能得到;(3)溶液A的目的是除去溶液中Mg2+、SO42一,根据Ksp越小的物质越先沉淀完全,因此应选含OH-和Ba2+的物质,即需要加入过量的Ba(OH)2溶液;加入过量K2CO3溶液的目的是除去Ba2+,而过量的OH-和CO32一则需要适量盐酸除去;pH=12,则c(H+)=10—12mol/L,c(OH—)=Kw/c(H+)=10—2mol/L;悬浊液中存在如下平衡:Mg(OH)2(s) 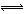 Mg2++2OH—,则Ksp[Mg(OH)2]=c(Mg2+)·c2(OH—),代入有关数据计算可得:c(Mg2+)=
Mg2++2OH—,则Ksp[Mg(OH)2]=c(Mg2+)·c2(OH—),代入有关数据计算可得:c(Mg2+)=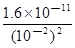 mol/L=
1.6×10—7mol/L。
mol/L=
1.6×10—7mol/L。
考点:考查物质制备型工艺流程题,涉及混合物分离提纯的操作方法、仪器、除杂试剂的选择及目的解释、溶度积的应用和计算等考点。


科目:高中化学 来源: 题型:阅读理解

 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com