
| A、单位时间内每生成 n mol N2,同时生成2 n mol NO |
| B、容器内反应混合物的总压强不随时间改变 |
| C、O2的消耗速率等于NO的消耗速率 |
| D、容器内始终有N2、O2和NO共存 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 的描述正确的是( )
的描述正确的是( )| A、分子中的所有C原子一定在同一平面上 |
| B、分子中的所有原子可能在同一平面上 |
| C、除苯环外的其他C原子有可能在一条直线上 |
| D、除苯环外的其他C原子不可能在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、由水电离产生c (H+)=10-10mol/L的溶液:NH4+、AlO2-、Ca2+、S2- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:K+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2+2OH--2e-=2H2O |
| B、O2+4H++4e-=2H2O |
| C、H2-2e-=2H+ |
| D、O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下反应C(s)+CO2(g)=2CO(g)不能自发进行,说明其△H<0 |
| B、25℃时PH=5的盐酸和PH=9的氨水,两溶液中水的电离程度不同 |
| C、25℃时Ksp(A)>Ksp(B),说明化合物A的溶解度比化合物B的大 |
| D、在NH4Cl溶液中加入适量的硫酸,可使c(NH4+):c(Cl-)接近1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量数均为14的碳原子和氮原子表示为:614C 714N |
B、甲烷的球棍模型: |
C、甲基的结构式: |
D、甲基负离子的电子式: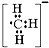 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com