
 工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,而升高温度平衡向吸热反应方向移动;
设在830℃下平衡时CO的转化率为x,表示出平衡时各组分物质的量,由于反应前后气体体积不变,可以用物质的量代替浓度代入平衡常数表达式列方程计算解答;
(2)各物质起始物质的量均为1:1等于化学计量数之比,结合方程式可知,故平衡时n(CO)=n(H2O)、n(CO2)=n(H2),由于500℃时平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=9可知,平衡时n(CO2)≠n(CO),则转化率不是50%;
B中转化到左边可以得到2molCO、2molH2O,恒温恒容下B、C是完全等效平衡,平衡时相同物质的浓度相同、物质的量相同;
恒温恒容下,C等效为在A的基础上增大压强,反应前后气体体积不变,平衡不移动,反应物转化率相等、相同物质的含量相等;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)在t2时刻后CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,可以通过改变温度、改变水蒸气或氢气的量实现;
t4时刻通过改变容积的方法将压强增大为原先的两倍,则体积变为原来的一半,瞬间浓度分别增大为原来的2倍,由于反应前后气体系数相等,平衡不移动.
解答 解:(1)反应CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数的表达式K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;
由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,而升高温度平衡向吸热反应方向移动,则正反应是放热反应;
设在830℃下平衡时CO的转化率为x,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 2 0 0
变化量(mol):x x x x
平衡量(mol):1-x 2-x x x
由于反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,则K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{x×x}{(1-x)×(2-x)}$=1,解得x=66.7%;
故答案:$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;放;66.7%;
(2)各物质起始物质的量均为1:1等于化学计量数之比,结合方程式可知,故平衡时n(CO)=n(H2O)、n(CO2)=n(H2),由于500℃时平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=9可知,平衡时n(CO2)≠n(CO),则转化率不是50%;
B中转化到左边可以得到2molCO、2molH2O,恒温恒容下B、C是完全等效平衡,平衡时相同物质的浓度相同、物质的量相同,则:c2=c3,B、C平衡时n(CO2)≠n(CO),转化率不是50%,故Q2≠Q3,设平衡时CO为ymol,则α3=$\frac{y}{2}$,α2=$\frac{2-y}{2}$,故α3+α2=1,可推知α3≠α2;
恒温恒容下,C等效为在A的基础上增大压强,反应前后气体体积不变,平衡不移动,反应物转化率相等、相同物质的含量相等,则:α1=α3,c3=2c1,Q3=2Q1,
结合上述分析可知:2c1=c2=c3 ,Q3=2Q1≠Q2=Q3 ,α1=α3≠α2 ,α1+α2=1,
故选:AD;
(3)①虽然反应前后气体体积不变,但由于绝热等容容器中反应过程中有温度变化,所以压强也在变化,体系的压强不再发生变化能判断反应达到平衡,故①正确;
②反应中混合气体总质量不变,容器容积不变,混合气体密度始终不变,故②错误;
③反应中混合气体总质量不变,反应前后气体的物质的量不变,混合气体的平均相对分子质量始终不变,故③错误;
④各组分的物质的量浓度不再改变是平衡的标志,故④正确;
⑤体系的温度不再发生变化绝热容器温度不变,说明反应达到平衡,故⑤正确;
⑥反应速率之比等于化学方程式计量数之比,v(CO2)正=v(H2O)逆说明水蒸气的正逆反应速率相同,反应到达平衡,故⑥正确;
故答案为:②③;
(4)在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现;
t4时刻通过改变容积的方法将压强增大为原先的两倍,则体积变为原来的一半,瞬间浓度分别增大为原来的2倍,由于反应前后气体系数相等,平衡不移动,在图中t4和t5区间内画出CO、CO2浓度变化曲线如图: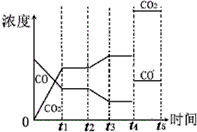 ,
,
故答案为:降低温度,或增加水蒸汽的量,或减少氢气的量; .
.
点评 本题考查化学平衡计算、化学平衡移动原理、平衡状态判断、化学平衡图象等,是对学生综合能力的考查,需要学生具备扎实的基础.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2HPO4+NaH2PO4 | B. | Na3PO4 | C. | NaH2PO4 | D. | Na3PO4+NaH2PO4 | ||||
| E. | Na3PO4+Na2HPO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热为-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3 kJ•mol-1) | |
| D. | 在101 kPa时,2 gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com