
| A、蒸发、蒸馏、萃取 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸馏、萃取、蒸发 |
科目:高中化学 来源: 题型:
| A、含氢元素的化合物中一定有氢键 |
B、因为分子间存在氢键的缘故,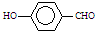 比 比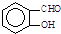 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、“可燃冰”--甲烷水合物(例如:8CH4?46H2O)中CH4与H2O之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
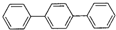 它的分子式为
它的分子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、Cl-、Na+、H+ |
| B、Al3+、K+、OH-、SO42- |
| C、Fe2+、NO3-、SO42-、H+ |
| D、K+、Al3+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com