
| A. | CH4 | B. | CH3Cl | C. | C2H6 | D. | C2H4 |
分析 A.正四面体中,4个键的键长、键角都相等,一般只有同种元素构成的化学键才能完全相同,甲烷为正四面体结构,C原子位于正四面体的中心;
B.一氯甲烷分子碳原子和氯原子、氢原子吸引电子的能力不同,所以一氯甲烷属于四面体结构;
C.乙烷中存在四面体,但分子不是正四面体结构;
D.乙烯是平面型分子.
解答 解:A.甲烷分子中碳原子位于正四面体中心上,四个顶点上分别含有一个氢原子,为正四面体结构,故A正确;
B.一氯甲烷是1个氯原子取代了甲烷中1个氢原子,结构为四面体,含有碳氢、碳氯极性键,分子不对称,不是正四面体,故B错误;
C.C2H6是1个甲基取代了甲烷中1个氢原子,存在四面体,但整个分子不是正四面体结构,故C错误;
D.C2H4中含有碳氢单键和碳碳双键,分子中C原子含有3个σ键电子对,没有孤电子对,其空间构型是平面形结构,故D错误;
故选A.
点评 本题考查了微粒空间构型的判断,根据正四面体中,4个键的键长、键角都相等,一般只有同种元素构成的化学键才能完全相同分析解答,注意CH4结构,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
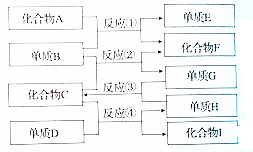
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
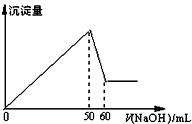 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
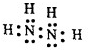
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com