
【题目】按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______mol/L。
【答案】 10∶1(或 10) 1∶10 V2﹥V3=V1 < 9.9×10-7 5.6×10-7
【解析】(1)体积为VaL、pH值为a的稀硫酸和体积为VbL,pH值为b的烧碱溶液混和,若所得混合液为中性。说明氢离子和氢氧根离子恰如完全反应,得到:Va×10-a=Vb×10b-14,如果a+b=15,计算得到Va:Vb =10-14+a+b=101=10:1;若所得混合溶液为中性,pH=b的NaOH溶液中c(H+)=10-bmol/L,c(OH-)=![]() mol/L,pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=
mol/L,pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=![]() mol/L×Vb,结合a+b=12整理可得:Va:Vb=1:10;(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3,所以消耗酸的体积关系为:V2>V3=V1;(3)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱。①HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度为
mol/L×Vb,结合a+b=12整理可得:Va:Vb=1:10;(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3,所以消耗酸的体积关系为:V2>V3=V1;(3)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱。①HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度为![]() mol/L,0.2mol/LMOH溶液中c(OH-)<0.2mol/L,则溶液中水电离的氢离子浓度大于
mol/L,0.2mol/LMOH溶液中c(OH-)<0.2mol/L,则溶液中水电离的氢离子浓度大于![]() mol/L,故0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+);②根据电荷守恒:c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L;③Na2CO3溶液的浓度为2×10-2mol/L,等体积混合后溶液中c(CO32-)=
mol/L,故0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+);②根据电荷守恒:c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L;③Na2CO3溶液的浓度为2×10-2mol/L,等体积混合后溶液中c(CO32-)=![]() ×2×10-2mol/L=1×10-2mol/L,根据Ksp(CaCO3)=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=
×2×10-2mol/L=1×10-2mol/L,根据Ksp(CaCO3)=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L。
mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】氢化铝锂(IiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应,并产生同一种气体。
回答下列问题:
I.制备氢化锂(IiH)
选择图1中的装置制备氢化锂(必要时可重复使用):
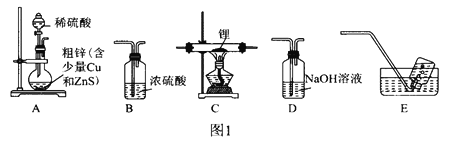
(1)装置D中NaOH溶液的作用是________________________________________。
(2)装置的连接顺序(从左至石)为A→__________________________________。
(3)检验好装置的气密性,点燃酒精灯前需进行的实验操作是____________________________________。
II.制备氢化铝理
1947 年,Schlesinger、Bond 和Finholt首次制得氢化铝理,其方法是使氢化锂与无水三氯化铝按定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(4)将乙醚换为去离子水是否可行,请简述理出:____________________________________。
(5)氢化锂与无水三氯化铝反应的化学方程式为___________________________________。
III.测定氢化铝锂产品(不含氢化锂)的纯度。
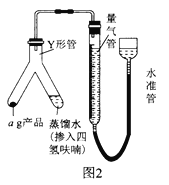
(6)按图2装配仪器、检查装置气密性并装好约品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是_________________。读数之前,上下移功量气管在右侧的容器,使量气管左、右两侧的液面在同一水平而上,其目的是___________________________。
(7)标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________________(用含a、V1、V2的代数式表示)。若起始读数时俯视刻度线,测得的结果将___________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
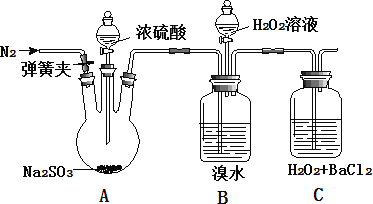
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品.这里的碘、铁、钙、硒、氟应理解为( )
A.元素
B.单质
C.分子
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《关于在我国统一实行法定计量单位的命令》,下列说法中规范的只有( )
A.98g H2SO4的摩尔数为1
B.阿伏加德罗常数为6.02×1023
C.氧的摩尔质量为32
D.某硫酸溶液中H2SO4的质量分数为0.60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸D.常温下镁与3mol/L的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
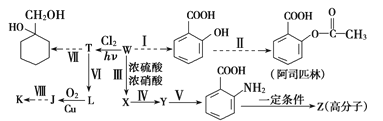
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照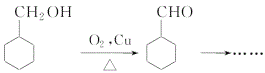 )_______
)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿的主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料,二氧化铈(CeO2) 是一种重要的稀土氧化物。以氟碳铈矿为原料制备CeO2的一种工艺流程如下:
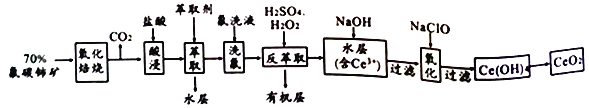
已知:①Ce 4+既能与F 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+ 能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1) “氧化焙烧”的目的是______________。
(2)“酸浸”中会产生大量黄绿色气体、请写出CeO2与盐酸反应的离子方程式___________________;为避免产生上述污染,请提出一种解决方案________________________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
(4) “反萃取”中,加稀硫酸和H2O2的作用__________________(用离子方程式表示)。
(5)取上述流程中得到的CeO2产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不参加反应)消25.00mL标准溶液,该产品中CeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指( )
A.氨水B.卤水C.醋D.硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com