
| A、NH+4、NO-3、CO32-、Cl- |
| B、Na+、HCO-3、K+、SO2-4 |
| C、MnO-4、K+、SO2-4、Na+ |
| D、Mg2+、Al3+、SO2-4、NO3- |


科目:高中化学 来源: 题型:
| A、硫酸、纯碱、小苏打和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、金属原子只有还原性,金属阳离子只有氧化性 |
| D、用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:

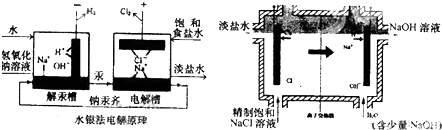
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应 |
| B、金属氧化物均为碱性氧化物 |
| C、蔗糖、液氨、干冰均为非电解质 |
| D、铝热剂是混合物,漂白粉为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3通入水中:SO3+H2O=H2SO4 |
| B、Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3 |
| C、HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O |
| D、CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| B、在0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、向0.2 mol?L-1NaHCO3溶液中加入等体积0.1 mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 所需要的仪器 | 所加的试剂名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/K | 298 | 398 | 498 |
| K/ | 4.1×106 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com