
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
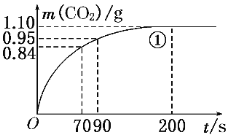
【答案】 1.00 35 25 2.00 大理石规格 0.01 mol/(L·s) 0-70
【解析】(1)(I)实验①和②探究浓度对反应速率的影响;
(II)实验①和③探究温度对反应速率的影响;
(Ⅲ)实验①和④中大理石的规格不同;
(2)先根据图象,求求出生成二氧化碳的物质的量,然后根据反应求出消耗硝酸的物质的量,最后计算反应速率;曲线斜率越大反应速率越快。
(1)实验①和②探究浓度对反应速率的影响,故硝酸的浓度不同,应该选1.00mol/L硝酸;由于①和③探究温度对反应速率的影响,故温度不同,应该选35℃;由于实验①和④大理石规格不同,因此探究的是固体物质的表面积对反应速率的影响,所以实验①和④中温度和硝酸的浓度均相同;
(2)由图可知70s至90s,生成CO2的质量为0.95g-0.84g=0.11g,物质的量为0.11g÷44g/mol=0.0025mol,根据反应CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O可知消耗HNO3的物质的量为2×0.0025mol=0.005mol,又溶液体积为0.025L,所以HNO3减少的浓度△c=0.005mol÷0.025L=0.2mol/L,反应的时间t=90s-70s=20s,所以HNO3在70s-90s范围内的平均反应速率为△c÷△t=0.2mol/L÷20s=0.01molL-1s-1;根据图像可知在O~70、70~90、90~200各相同的时间段里曲线的斜率最大是0-70时间段内,因此反应速率最大的时间段是0-70。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1 025kJmol﹣1是一个可逆反应.若反应物起始物质的量相同,则如图中关于该反应不正确的是( )
A.
B.
C.
D.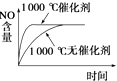
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2﹣丁烯与氢气反应的化学方程式为 , 反应类型为 .
(2)烯烃A是2﹣丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为;A分子中能够共平面的碳原子个数为 , A与溴的四氯化碳溶液反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯贝特(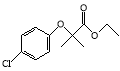 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:
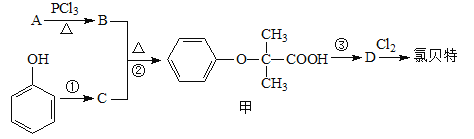
提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.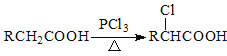
Ⅲ.![]()
⑴氯贝特的分子式为 。
⑵若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为 。(相对原子质量:H-1、C-12、O-16)
⑶要实现反应①所示的转化,加入下列物质不能达到目的的是 (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
⑷反应②的反应类型为 ,其产物甲有多种同分异构体,同时满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
① 1,3,5-三取代苯;
② 属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应;
③ 1 mol该同分异构体最多能与3 mol NaOH反应。
⑸写出B与足量NaOH溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构或反应特征的描述正确的是
A. 组成为C4H10的烷烃中仅能由两种烯烃与氢气加成而制得
B. 某烃的化学式为C9H12,则该烃一定是苯的同系物
C. ![]() 中反应①②分别是取代反应、加成反应
中反应①②分别是取代反应、加成反应
D. 1个含有5 个碳原子的烃分子中,最多可含有4个碳碳单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是

A. O2-向正极移动
B. 负极的电极反应式为:NO-2e-+O2-=NO2
C. O2的电极反应产物是H2O
D. 反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸银是一种无色晶体,常用于照相、制镜、印刷、医药等。其水溶液和固体常被保存在棕色试剂瓶中,硝酸银不稳定,受热分解生成固体、NO2和O2。为了研究AgNO3的受热分解产物的性质,某同学设计了以下实验:实验所用的装置如图(图中加热、夹持仪器等均略去):
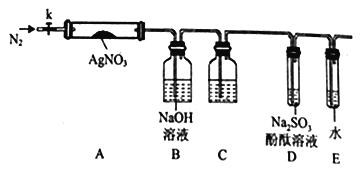
实验步骤为:a.仪器连接后,放入AgNO3固体之前,关闭k,微热硬质玻璃管A。
b.称取AgNO3固体1.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A装置冷却至室温、称量,测得剩余园体的质量为1.08g。……
请回答下列问题:
(1)使用酒精灯对AgNO3固体加热的操作方法是________________________。
(2)步骤a的操作目的是_________________________________________。
(3)步骤b中先通入一段时间N2的操作目的是_______________________________。
(4)装置C瓶中盛装的药品名称为___________,装置D中可观察到的实验现象为___________。
(5)设计实验证明AgNO3分解产物中气体的体积比________________________________。
(6)从实验安全角度考虑该实验装置有缺陷,应如何改进?_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从氧化还原角度分析,下列反应中水的作用相同的是
①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法正确的是
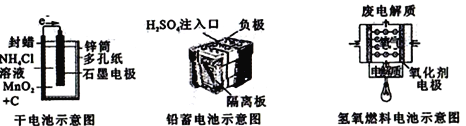
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,H+向锌筒移动
C. 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g
D. 氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com