
| A.MgCl2 | B.FeCl2 | C.AlCl3 | D.CuCl2 |
科目:高中化学 来源:不详 题型:填空题
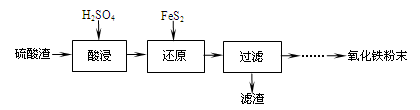
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金不溶于任何溶液 |
| B.铜、锌在空气中均能被氧化成对应的氧化物 |
| C.铜锌合金的熔点低于铜或锌的熔点 |
D. 的质子数和中子数之差为34 的质子数和中子数之差为34 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②⑤ | D.④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeSO4 | B.Fe2(SO4)3 | C.KNO3 | D.HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
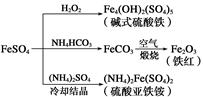
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
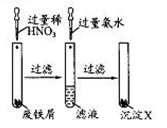
| A.滤液的溶质是Fe(NO3)2 |
| B.该实验中发生的反应都为氧化还原反应 |
| C.沉淀X为Fe(OH)2 |
| D.沉淀X受热分解得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
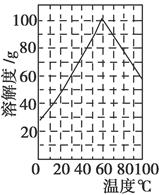
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com