
���� �ٺ�A��������ɫ��ӦΪ��ɫ����A��NaԪ�أ�
��B��ԭ�����������������ڲ��������3������K��Ϊ������⣬����������������8������B��OԪ�أ�
��C�����������Neԭ�ӵĵ�������ͬ�����ھ�����ͬ�������ļ����������Ӱ뾶��С����C��AlԪ�أ�
��D��B����ͬ������Ϊ������Ԫ�أ���D��SԪ�أ�
��Ŀǰ������֪�����ʣ������˹���������ʣ��У������������EԪ�أ���E��CԪ�أ�
��FԪ�ص�ij��ԭ����ֻ�����ӣ�û�����ӣ���F��HԪ�أ�
��1������֪����Ԫ���е�������ɵ�������ˮ�������У��ܴٽ�ˮ����������Ǻ��������ӵ��Σ�������ˮ�����������ǿ�ᡢǿ���ǿ����ʽ�Σ�
��2�����ֺ�ˮ��Դ�������������õ��ӷ�����ԭ��Ӧ��
��3��A������������ˮ������NaOH��n��NaOH��=1.5L��0.1mol•L-1=0.15mol��n��CO2��=$\frac{2.24}{22.4L/mol}$=0.1mol��n��NaOH����n��CO2��=0.15��0.1=3��2�����߷�Ӧ����Һ�е�����Ϊ�����ʵ�����Na2CO3��NaHCO3��CO32-��HCO3-��ˮ�ˮ��̶�CO32-��HCO3-�������Ӳ�ˮ�⣬��Һ�ʼ��ԣ�
��4���ܶȻ�����ԽС������Խ�����ɳ������ո���������ʱ����Һ��c��OH-��=$\root{3}{\frac{{K}_{sp}[Fe��OH��_{3}]}{c��F{e}^{3+}��}}$mol/L=10-12mol/L����Һ��c��H+��=$\frac{{K}_{w}}{c��O{H}^{-}��}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L��pH=-lgc��H+����
��� �⣺�ٺ�A��������ɫ��ӦΪ��ɫ����A��NaԪ�أ�
��B��ԭ�����������������ڲ��������3������K��Ϊ������⣬����������������8������B��OԪ�أ�
��C�����������Neԭ�ӵĵ�������ͬ�����ھ�����ͬ�������ļ����������Ӱ뾶��С����C��AlԪ�أ�
��D��B����ͬ������Ϊ������Ԫ�أ���D��SԪ�أ�
��Ŀǰ������֪�����ʣ������˹���������ʣ��У������������EԪ�أ���E��CԪ�أ�
��FԪ�ص�ij��ԭ����ֻ�����ӣ�û�����ӣ���F��HԪ�أ�
��1������֪����Ԫ���е�������ɵ�������ˮ�������У��ܴٽ�ˮ����������Ǻ��������ӵ��Σ���Al2��SO4��3����Na2CO3��Na2SO3��NaHS�ȣ���������ˮ�����������ǿ�ᡢǿ���ǿ����ʽ�Σ���H2SO4����H2SO3��H2CO3��NaOH�ȣ���
�ʴ�Ϊ��Al2��SO4��3����Na2CO3��Na2SO3��NaHS�ȣ���H2SO4����H2SO3��H2CO3��NaOH�ȣ���
��2�����ֺ�ˮ��Դ�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H2O+O2+4e-�T4OH-���ʴ�Ϊ��2H2O+O2+4e-�T4OH-��
��3��A������������ˮ������NaOH��n��NaOH��=1.5L��0.1mol•L-1=0.15mol��n��CO2��=$\frac{2.24}{22.4L/mol}$=0.1mol��n��NaOH����n��CO2��=0.15��0.1=3��2�����߷�Ӧ����Һ�е�����Ϊ�����ʵ�����Na2CO3��NaHCO3��CO32-��HCO3-��ˮ�ˮ��̶�CO32-��HCO3-�������Ӳ�ˮ�⣬��Һ�ʼ��ԣ�������Ũ�ȴ�С˳����c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
��4���ܶȻ�����ԽС������Խ�����ɳ������ո���������ʱ����Һ��c��OH-��=$\root{3}{\frac{{K}_{sp}[Fe��OH��_{3}]}{c��F{e}^{3+}��}}$mol/L=10-12mol/L����Һ��c��H+��=$\frac{{K}_{w}}{c��O{H}^{-}��}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L��pH=-lgc��H+��=-lg0.01=2��
�ʴ�Ϊ��Fe��OH��3��2��
���� ���⿼��λ�ýṹ���ʵ����ϵ��Ӧ�ã��漰����ˮ�⡢������ʵĵ��롢����Ũ�ȴ�С�Ƚϡ��ܶȻ��������йؼ����֪ʶ�㣬�ۺ��Խ�ǿ���ѵ�������Ũ�ȴ�С�Ƚϼ��ܶȻ��������㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ������ϡ�������ǿ������ | |
| B�� | ijǿ������Һ�к��н϶��SO32-��S2- | |
| C�� | SO2��H2SO3��H2S�����л�ԭ�� | |
| D�� | ��BaCl2��Һ���ɰ�ɫ������ԭ��Һ��һ������SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �٢ڢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʧ���ӵķ�ӦΪ��ԭ��Ӧ | |
| B�� | �����ڱ仯��ʧȥ���ӣ��������������� | |
| C�� | ��������ת�Ƶķ�Ӧ����������ԭ��Ӧ | |
| D�� | �������ϼ������ķ�Ӧ��һ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
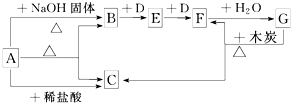
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
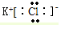 ��CO2
��CO2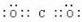
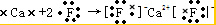
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com