
分析 (1)加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,
由Mg$\stackrel{2HCl}{→}$MgCl2$\stackrel{2NaOH}{→}$Mg(OH)2,Al$\stackrel{3HCl}{→}$AlCl3$\stackrel{3NaoH}{→}$Al(OH)3,根据关系式计算;
(2)设出合金中镁、铝的物质的量,分别根据合金质量、设出沉淀的质量列式计算.
解答 解:加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,
即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,所以n(NaOH)=0.4L×1mol/L=0.4mol,
(1)根据Mg$\stackrel{2HCl}{→}$MgCl2$\stackrel{2NaOH}{→}$Mg(OH)2、Al$\stackrel{3HCl}{→}$AlCl3$\stackrel{3NaoH}{→}$Al(OH)3可知:3.9gMg、Al合金最终得到的是Mg(OH)2和Al(OH)3沉淀,
且满足:沉淀的质量m(氢氧化物)=m(合金)+m(OH-),
根据转化关系式可知:n(OH-)=n(NaOH)=0.4mol,则m(OH-)=0.4mol×17g/mol=6.8g,
所以沉淀的质量为:m(氢氧化物)=m(合金)+m(OH-)=3.9g+6.8g=10.7g,
答:生成的沉淀的最大值是10.7g;
(2)设3.9gMg、Al合金中Mg的物质的量为x,Al的物质的量为y,则:24x+27y=3.9、58x+78y=10.7,
解得:x=0.05mol、y=0.1mol,
即:镁、铝的物质的量分别为0.05mol、0.1mol,
所以Mg的质量为:0.05mol×24g/mol=1.2g,
原合金中Mg的质量百分含量为:$\frac{1.2g}{3.9g}$=30.8%,
答:原合金中Mg的质量百分含量为30.8%.
点评 本题考查混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意关系式法和守恒法在解答中的重要应用,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 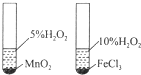 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 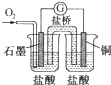 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2HCl$\frac{\underline{\;通电\;}}{\;}$Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
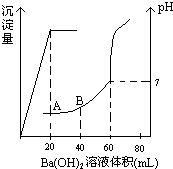 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com