
锂电池的构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6 LiCoO2+6C,下列说法错误的是
LiCoO2+6C,下列说法错误的是
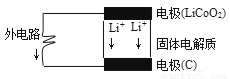
A.该电池的负极为LiCoO2
B.电池中的固体电解质可以是熔融的氯化钠、干冰等
C.充电时的阴极反应:Li1-xCoO2+xLi++xe-=LiCoO2
D.外电路上的“→”表示放电时的电子流向
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
2014年度诺贝尔化学奖授予了研制出超高分辨率荧光显微镜的三位科学家。该仪器可用于研究细胞结构和功能等。则下列有关仪器分析说法中错误的是
A.原子吸收光谱仪可用于测定物质中的金属元素
B.质谱仪不能用于分析有机化合物的结构
C.红外光谱仪可用于测定有机化合物的官能团
D.氢核磁共振仪能鉴别CH3COOCH2CH3与CH3CH2COOCH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.参加反应的硝酸的物质的量为0.4mol
B.加入合金的质量可能为9.6g
C.沉淀完全时消耗NaOH溶液体积为150mL
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
A、一些纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
B、植物油、脂肪、矿物油、人造奶油的主要成分都是高级脂肪酸甘油酯。
C、首先在实验室制得金属钠的科学家是戴维,同时他还制得了金属镁。
D、氢气是21世纪极有前途的新型能源,科学家可以利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气从而利用氢能。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于
A.8.64g B.9.44g C.9.00g D.9.20g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④非极性键也可能存在于离子化合物中
A.①④ B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法不正确的是
A.葡萄糖可用于补钙药物的合成
B.二氧化硫可广泛用于食品的漂白
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O===SO42—+2Fe2++4H+;②Cr2O72—+6Fe2++14H+===2Cr3++6Fe3++7H2O。下列有关说法错误的是
A.氧化性:Cr2O72—>Fe3+>SO2
B.K2Cr2O7能将Na2SO3氧化成Na2SO4
C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:实验题
(14分)用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
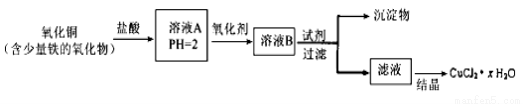
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用 。
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用 。
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需 ,下列滴定方式中(夹持部分略去),最合理的是 (填序号)

写出滴定反应的离子方程式___ __。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中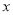 的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1 g。
方案二:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得固体的质量为n2 g。
试评价上述两种实验方案:其中正确的方案是 ,据此计算得x= (用含m、n1或n2的代数式表示)。
(6)某同学想利用氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL)。
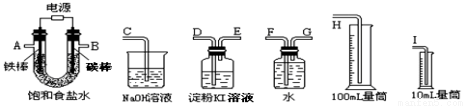
试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接 , 接 ;B接 , 接 ;
(7)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电。将U形管内的溶液倒入烧杯,其pH约为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com