
 ����ʱ������˫���꣨H2Dz����Ԫ���ᣩ�ѽ���������ϳɵ����Ե����ʣ�����CCl4��ȡ�����Ӷ��ѽ������Ӵ�ˮ��Һ����ȫ�������������˫���꣨H2Dz����CCl4������ˮ�е�Cu2��ʱ���ȷ�����Ϸ�Ӧ��
����ʱ������˫���꣨H2Dz����Ԫ���ᣩ�ѽ���������ϳɵ����Ե����ʣ�����CCl4��ȡ�����Ӷ��ѽ������Ӵ�ˮ��Һ����ȫ�������������˫���꣨H2Dz����CCl4������ˮ�е�Cu2��ʱ���ȷ�����Ϸ�Ӧ�� Cu(HDz)2+2H����
Cu(HDz)2+2H����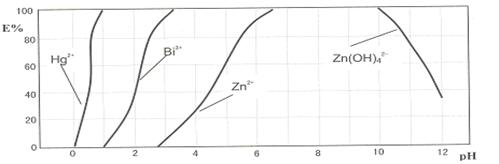
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ṥҵ����SO3�ķ�Ӧ�����ǣ����¡���ѹ������ |
| B���ϳɰ����������ǣ�400��500 �桢10Mpa ��30 MPa������ý |
| C����������ѭ������ |
| D�������Ƚ���װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
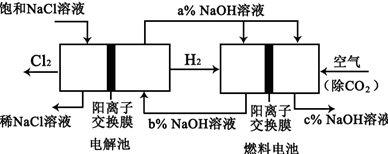
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ | B������ | C���� | D�����Ȼ�̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��Fe | B��Ca(OH)2 | C��NH3?H2O | D��NaOH |
 ���ķ�ӦΪ��
���ķ�ӦΪ�� 92�������Ʒ����������茶��崿�ȵļ���ʽ�ɱ���Ϊ��w%= ��
92�������Ʒ����������茶��崿�ȵļ���ʽ�ɱ���Ϊ��w%= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������CeO2��Ce������������� |
B�����������ȶ��ĺ��� Ce�� Ce��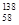 Ce�� Ce��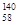 Ce�� Ce��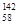 Ce�����ǻ�Ϊͬ�������� Ce�����ǻ�Ϊͬ�������� |
| C����Ce��SO4��2��Һ�ζ�����������Һ�������ӷ���ʽΪ��Ce4++Fe2+=Ce3++Fe3+ |
| D�������������Ļ�ѧ����ʽ�ɱ�ʾΪ��Ce+4HI=CeI4+2H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

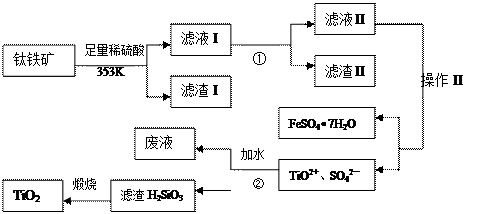
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������õİ뵼����ϣ�����Ϣ�����Ĺؼ����� |
| B���������÷��ܡ�̫���ܡ��������ܵ�����Դ���ϡ���̼���á�ս�� |
| C���������������п�飬�ɼ�������ĸ�ʴ |
| D���������pH <7����ˮ����Ҫ���ɴ����е�SO2��NO2����ɵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
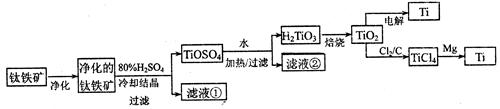
 TICl4��l�� +O2��g��˳�����е�ԭ����:
TICl4��l�� +O2��g��˳�����е�ԭ����: �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com