
分析 (1)依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积等于溶液中离子浓度幂次方乘积;
(2)A.依据氯化银沉淀溶解平衡分析,银离子浓度增大,平衡向沉淀方向进行;
B.物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;
C.氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;
D.Mg(OH)2的溶解度比MgCO3小;
E.为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全;
(3)AgI的饱和溶液中存在沉淀溶解平衡:AgI(s)?Ag+(aq)+I-(aq),
①加入AgNO3固体,相当于增加Ag+浓度,反应向生成沉淀方向进行;
②加入更多的AgI固体,由于此时已经是饱和AgI溶液,不会再溶解AgI;
③加入固体AgBr,且AgI比AgBr难溶,沉淀转化趋势不大,相当于增加Ag+浓度,反应向生成沉淀方向进行.
解答 解:(1)对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,Ksp=c(Ag+)2•c(S2-),
故答案为:c(Ag+)2•c(S2-);
(2)A.氯化银沉淀溶解平衡中存在溶度积常数,Ksp=c(Ag+)c(Cl-),银离子浓度增大,平衡向沉淀方向进行;用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B.物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的,故B错误;
C.氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡,故C正确;
D.Mg(OH)2的溶解度比MgCO3小,故D错误;
E.为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全,故E正确;
故答案为:B、D;
(3)AgI的饱和溶液中存在沉淀溶解平衡:AgI(s)?Ag+(aq)+I-(aq),
①加入AgNO3固体,相当于增加Ag+浓度,反应向生成沉淀方向进行,溶液中c(I-)变小,
故答案为:减小;
②加入更多的AgI固体,由于此时已经是饱和AgI溶液,不会再溶解AgI,则c(Ag+)不变;
故答案为:不变;
③加入固体AgBr,且AgI比AgBr难溶,沉淀转化趋势不大,相当于增加Ag+浓度,反应向生成沉淀方向进行,则溶液中c(I-)变小;
故答案为:减小.
点评 本题考查了沉淀溶解平衡的计算应用,平衡移动的影响因素,难溶物质的溶解度比较方法,分析沉淀溶解平衡的影响因素的分析判断平衡移动的方向,题目难度中等.


科目:高中化学 来源: 题型:解答题
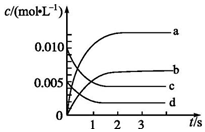 在2L密闭容器中,800℃时2NO(g)+O2(g)?2NO2(g)反应体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时2NO(g)+O2(g)?2NO2(g)反应体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )| A. | Y、Z组成的化合物只含离子键 | |
| B. | 氢化物的沸点和稳定性排序:R<Y | |
| C. | 最高价氧化物对应的水化物的酸性:T>R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①③④ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应是指反应物的总能量高于生成物的总能量 | |
| B. | 放热反应是指反应物的总键能高于生成物的总键能 | |
| C. | 核外电子总数相同的电中性原子,一定是同种元素的原子 | |
| D. | 二氧化氮与水反应能生成硝酸,所以二氧化氮是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

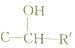
 、
、 、
、
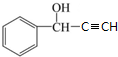 ,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 的路线(无机试剂任选):
的路线(无机试剂任选):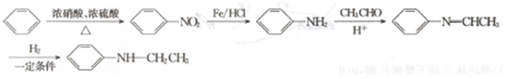 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 16种 | C. | 7种 | D. | 49种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com