
| A. | 高锰酸钾 | B. | 氯化铁 | C. | 浓溴水 | D. | 水 |
分析 己烯、苯、四氯化碳、氢氧化钠溶液、苯酚溶液、碘化钾溶液,分别与溴水混合的现象为:溴水褪色后分层、分层后有机色层在上层、分层后有机层在下层、溴水褪色后不分层、白色沉淀、溶液变为紫红色,以此来解答.
解答 解:A.高锰酸钾不能鉴别己烯、苯酚,故A错误;
B.四氯化碳、己烯、苯均不与氯化铁溶液反应,己烯、苯均在上层现象相同,不能鉴别,故B错误;
C.加入浓溴水,己烯、苯、四氯化碳、氢氧化钠溶液、苯酚溶液、碘化钾溶液,分别与溴水混合的现象为:溴水褪色后分层、分层后有机色层在上层、分层后有机层在下层、溴水褪色后不分层、白色沉淀、溶液变为紫红色,可鉴别,故C正确;
D.加入水,己烯、苯都不溶解,且密度比水小,氢氧化钠溶液、苯酚溶液、碘化钾溶液无现象,不能鉴别,故D错误.
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质及萃取现象为解答的关键,侧重常见有机物性质的考查,注意现象相同不能鉴别物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
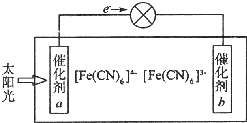 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 含有SO42- 或Ag+ | ||
| C. | 含有SO42- 或Ag+ 或SO32- | D. | 可能含有SO32- 或CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 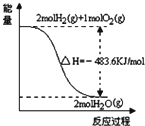 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为-241.8kJ•mol-1 | |
| B. | 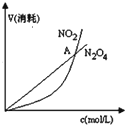 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 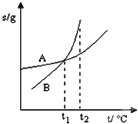 表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 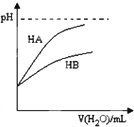 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化.则NaA溶液的pH小于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

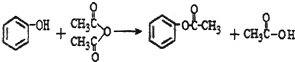
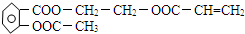 .
.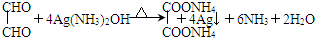
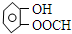 (或间、对位)
(或间、对位)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

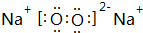 ,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为
,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为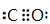 、
、 ;
;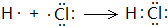 ;
; 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com