
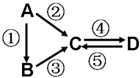
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:分析 (1)若A是当前最常用的太阳能转换为电能的材料,C的水溶液俗称水玻璃,D为硅酸,则A为Si,C为Na2SiO3,B为SiO2,反应②为Si与氢氧化钠反应转化为硅酸钠与氢气,反应③是二氧化硅与氢氧化钠反应生成硅酸钠与水;
(2)若A是空气中含量最多的气体为N2,B气体用于工业制硝酸,D是红棕色气体为NO2,则C为NO,判断B为NH3,据此书写化学方程式,B为氨气,是碱性气体,依据检验氨气的实验方法设计检验方法;
(3)若D物质是常见的两性氢氧化物,A为金属单质,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2,则D为Al(OH)3,C为偏铝酸盐,A为Al,B为氧化铝.
解答 解:(1)若A是当前最常用的太阳能转换为电能的材料,C的水溶液俗称水玻璃,D为硅酸,则A为Si,C为Na2SiO3,B为SiO2,硅的原子序数为14,原子核外3个电子层,最外层4个电子,位于周期表中第三周期IVA族,反应③是二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,
故答案为:第三周期IVA族; SiO2+2NaOH=Na2SiO3+H2O;
(2 )若A是空气中含量最多的气体为N2,B气体用于工业制硝酸,D是红棕色气体为NO2,则C为NO,判断B为NH3,反应③的化学方程式是氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4 NH3+5 O2$\frac{\underline{催化剂}}{△}$ 4 N O+6 H2O,实验室检验B气体的方法是:用湿润的红色石蕊试纸靠近气体,试纸变蓝则说明该气体为NH3或者用玻璃棒蘸浓盐酸靠近气体,出现白烟则说明该气体为NH3 ,
故答案为:4 NH3+5 O2$\frac{\underline{催化剂}}{△}$ 4 N O+6 H2O;用湿润的红色石蕊试纸靠近气体,试纸变蓝则说明该气体为NH3或者用玻璃棒蘸浓盐酸靠近气体,出现白烟则说明该气体为NH3 ;
(3 ) 若D物质是常见的两性氢氧化物,A为金属单质,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2,则D为Al(OH)3,C为偏铝酸盐,A为Al,B为氧化铝,则:反应②的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,反应③为:Al2O3+2NaOH=2NaAlO2+H2O,反应④的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,反应⑤为Al(OH)3+OH-=AlO2-+2 H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al(OH)3+OH-=AlO2-+2 H2O.
点评 本题考查无机物推断,涉及Al、Si、N元素化合物性质,需要学生熟练掌握元素化合物性质,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加过量的氨水:4NH3•H2O+Al3+═AlO2-+4NH4++2H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NH4++4OH-=Al(OH)3↓+NH3•H2O | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H4 | C. | C3H8 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
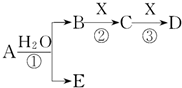 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,A的结构简式CH2=CH2.
,A的结构简式CH2=CH2. ,反应类型取代反应.
,反应类型取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com