
【题目】工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
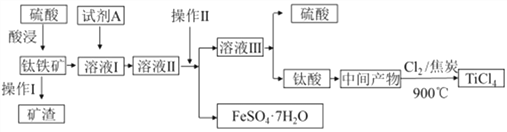
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。
【答案】 +4 铁粉(或 Fe) A 结晶、过滤 6 2Cl2 +TiO2 +C ![]() TiCl4 + CO2 (产物为 CO 也可) ① C 与 O2反应减小 O2的浓度使平衡向右移动 ②C与O2反应放热, 温度升高使平衡向右移动, 促使反应顺利进行 TiCl4 +(x+2)H2O ==TiO2·xH2O + 4HCl
TiCl4 + CO2 (产物为 CO 也可) ① C 与 O2反应减小 O2的浓度使平衡向右移动 ②C与O2反应放热, 温度升高使平衡向右移动, 促使反应顺利进行 TiCl4 +(x+2)H2O ==TiO2·xH2O + 4HCl
【解析】(1)由反应方程式可得,FeTiO3和H2SO4反应生成FeSO4、TiOSO4和H2O,该反应为非氧化还原反应,Fe元素化合价为+2价,根据化合物中正负化合价代数和为0,可知FeTiO3中钛元素的化合价为+4。
(2)溶液I为FeSO4和TiOSO4的混合溶液,通过后续流程中的物质可以判断,加入试剂A后并没有引入新元素,又因为经过操作II得到了FeSO4·7H2O,而亚铁离子容易被氧化,所以试剂A为铁粉(或Fe);加入A的目的是防止Fe2+被氧化。操作II从溶液得到FeSO4·7H2O晶体,所以操作II除了浓缩、冷却外,还有结晶、过滤。
(3)Q=c(Fe2+)×c2(OH-)=0.49×c2(OH-)<Ksp[Fe(OH)2]=4.9×10-17时不会生成Fe(OH)2沉淀,则c(OH-)<10-8,c(H+)=Kw/c(OH-)>10-6,所以pH不超过6。
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)![]() TiO2(s)+H2O(g),上述工艺流程中钛酸煅烧得到的中间产物与Cl2和焦炭在900℃时反应生成TiC14,所以生成TiCl4化学方程式为:2Cl2+TiO2+C
TiO2(s)+H2O(g),上述工艺流程中钛酸煅烧得到的中间产物与Cl2和焦炭在900℃时反应生成TiC14,所以生成TiCl4化学方程式为:2Cl2+TiO2+C ![]() TiCl4+CO2(或者2Cl2+TiO2+2C
TiCl4+CO2(或者2Cl2+TiO2+2C ![]() TiCl4+2CO)。若要TiO2(s)与Cl2(g)高温条件直接反应生成TiC14(l)和O2(g),该反应极难进行,当向反应体系中加入焦炭后,根据化学平衡移动原理:①C与O2反应减小了O2的浓度使平衡向右移动,②C与O2反应放热,温度升高使平衡向右移动,促使反应顺利进行。
TiCl4+2CO)。若要TiO2(s)与Cl2(g)高温条件直接反应生成TiC14(l)和O2(g),该反应极难进行,当向反应体系中加入焦炭后,根据化学平衡移动原理:①C与O2反应减小了O2的浓度使平衡向右移动,②C与O2反应放热,温度升高使平衡向右移动,促使反应顺利进行。
(5)利用TiCl4水解制TiO2·xH2O,根据原子守恒,该反应的化学方程式为:TiCl4+(x+2)H2O=TiO2xH2O+4HCl。


科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是
A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯化物种数最少的是丙 D. 甲中所有原子一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是
A. 原子半径:Al>Na B. 第一电离能:Al<Na
C. 基态原子未成对电子数:Na = Al D. 硬度:Na>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五瓶透明溶液,分别是Na2CO3、BaCl2、HCl、NaHSO4、AgNO3中的一种。
①A与D反应有气体生成; ②A与E反应有沉淀生成;
③B与E反应有沉淀生成; ④B与C反应有沉淀生成 ;
⑤C与D反应有气体生成; ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是_______________
(2)D为_________________,E为__________________。
(3)B与D反应的离子方程式为____________________________________。
(4)向一定量的Ba(HCO3)2溶液中,逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为:________________________________,沉淀完全后,继续滴加C溶液,此时发生反应的化学方程式为:__________________________________。
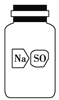
(5)实验室有一瓶标签破损(如图所示)的固体试剂。某同学取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请给出
进一步验证的实验方案(要求:所用试剂只能从A、B、C、D、E中选择):__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g含氧化铁、氧化铜或氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是 ( )
A. (m-16)g B. (m+16)g
C. (m-32)g D. 16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G 七种烃的分子球棍模型如图所示,据此回答下列问题:
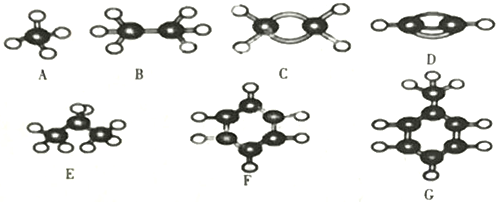
(1)能够发生加成反应的烃有_____________种。
(2)与A互为同系物的是__________(填字母)。
(3)工业上可用有机物C来合成乙醇,写出该反应的化学方程式:__________________________。
(4)烯烃在一定条件下被氧化时,由于![]() 断裂,转化为醛或酮。如:
断裂,转化为醛或酮。如:
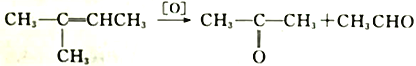
某有机物H与上述有机物C互为同系物,其所含碳原子数是有机物C的4倍,发生上述类似条件的反应时只有一种产物,且该产物不能发生银镜反应,写出该产物的结构简式: _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫化铜精矿为原料生产CuCl的工艺过程如下:
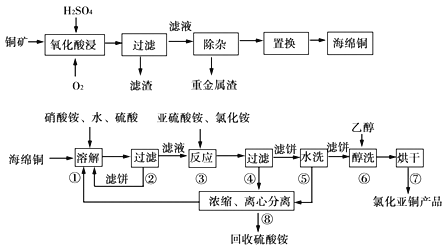
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的伓系,在潮湿空气中易水解氧化,海绵铜Cu中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量臼色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中![]() 为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(8)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7,溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加徳罗常数的值,下列说法中正确的是
A. 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1 NA
B. 常温常压下,36g 18O2中所含的中子数为16 NA
C. 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2 NA
D. 标准状况下,11.2LH2O中含有H—O键的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com