
| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ 分解反应 | |
| C. | CuO+CO═Cu+CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
分析 A.化合反应是有两种或两种以上的物质生成一种物质的化学反应,特征是:多变一;
B.分解反应是一变多;
C.置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应;
D.复分解反应是两种化合物互相交换成分生成另外两种化合物的反应.
解答 解:A.CO2+H2O═H2CO3只生成一种物质是化合反应,故A正确;
B.Cu2(OH)2CO3═2CuO+H2O+CO2↑ 一种物质生成多种物质是分解反应,故B正确;
C.CuO+CO═Cu+CO2没有单质反应,不是置换反应,故C错误;
D.NaCl+AgNO3═AgCl↓+NaNO3是在溶液中交换离子的反应属于复分解反应,故D正确.
故选C.
点评 本题考查化学基本反应类型,题目难度不大,要加强记忆有关的知识点,并理解应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.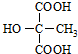 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4am/b | B. | 22.4b/am | C. | 22.4bm/a | D. | 22.4a/bm |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl3与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟硝酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g水中含有的水分子数是2NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 常温常压下,1molCH4的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com