
| A. | 石油、煤和天然气都是重要的化石燃料 | |
| B. | 淀粉、蔗糖和蛋白质均能发生水解反应 | |
| C. | 羊毛、塑料和橡胶均属于合成高分子材料 | |
| D. | 糖类、油脂和蛋白质都含有C、H、O三种元素 |
科目:高中化学 来源: 题型:填空题
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
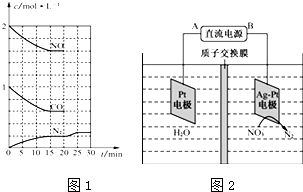
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均可作为水果催熟剂 | |
| B. | 二者均可使酸性高锰酸钾溶液褪色 | |
| C. | 常温常压下二者均为难溶于水的气体 | |
| D. | 在一定条件下二者均能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用向上排空气法收集氨气 | |
| B. | 氨气极易溶于水,因此加热浓氨水不会产生氨气 | |
| C. | 将两根分别蘸有浓氨水和浓硫酸的玻璃棒靠近时,有白烟产生 | |
| D. | 在实验室中,可用加热氢氧化钙和氯化铵的固体混合物的方法制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
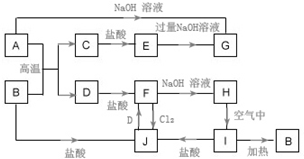 A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.
A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S | D. | 气态氢化物稳定性:HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3胶体能疑凝聚水中悬浮物 | |
| B. | 铝易被氧化,但氧化生成的氧化铝具有保护内部铝的作用 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | Al(OH)3能溶于NaOH溶液、氨水和稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com