
高铁酸盐在能源环保领域有广泛用途,用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
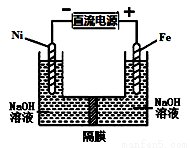
A.镍电极上的电极反应为2H2O+2e- H2↑+2OH-
H2↑+2OH-
B.铁是阳极, 电极反应为Fe-2e-+OH- Fe(OH)2
Fe(OH)2
C.若隔膜为阴离子交换膜, 则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高, 最终溶液pH不变
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2
B.S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2
C.C(s)+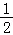 O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
D.H2(g)+Cl2(g)═2HCl(g);△H1 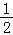 H2(g)+
H2(g)+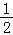 Cl2(g)═HCl(g);△H2
Cl2(g)═HCl(g);△H2
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(NH4+)随反应进行逐渐减小。下列判断错误的是( )
A.反应的氧化剂是ClO- B.消耗1 mol还原剂,转移电子3 mol
C.氧化剂与还原剂的物质的量之比为2:3 D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知还原性Cl-< Br-< Fe2+<I-,氧化性Cl2>Br2>Fe3+> I2,则下列说法正确的是
A.在含有 Br-、Fe2+、I-的溶液中欲只氧化I-而不氧化Br-、Fe2+,可用FeBr3作试剂
Br-、Fe2+、I-的溶液中欲只氧化I-而不氧化Br-、Fe2+,可用FeBr3作试剂
B.向FeI2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++ Cl2=2Fe3++ 2C1-
C.向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2+ +2Br-+2Cl2=2Fe3++ Br2+4Cl-
D.向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++ I2=2Fe3++ 2I-,
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:填空题
〔化学——选修2:化学与技术〕
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
⑴海水中盐的开发利用:
Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和_______池。
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用______________。(写一点即可)
⑵ 电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示。请回答后面的问题:

Ⅰ.海水不能直接通入到该装置中,理由是 。
Ⅱ. B口排出的是________(填“淡水”或“浓水”)。
⑶ 用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
Ⅰ.若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为____________________
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?________
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是________________
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:选择题
化学与生产、生活、环境密切相关。下列说法错误的是( )
A.自行车钢架生锈主要是电化学腐蚀所致
B.硫酸钠溶液和氯化钡溶液均能使蛋白质变性
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市六校协作体高二上期初考试化学卷(解析版) 题型:推断题
短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。

(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:

其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
分子式为C4H8Br2且分子中仅含有两个甲基的有机物共有(不考虑立体异构):
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com