
| A. | $\frac{r(Ca)}{r(Mg)}$ | B. | $\frac{r(C{l}^{-})}{r(A{l}^{3+})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(N{a}^{+})}{r({F}^{-})}$ |
分析 电子层数越多半径越大;电子层数相同时,原子序数越大,半径越小;同种元素原子半径大于阳离子半径,阴离子半径大于原子半径,据此分析.
解答 解:A.电子层数越多半径越大,则$\frac{r(Ca)}{r(Mg)}$>1,故A错误;
B.电子层数越多半径越大,则$\frac{r(C{l}^{-})}{r(A{l}^{3+})}$>1,故B错误;
C.电子层数相同时,原子序数越大,半径越小,则$\frac{r(Na)}{r(Mg)}$>1,故C错误;
D.电子层数相同时,原子序数越大,半径越小,则$\frac{r(N{a}^{+})}{r({F}^{-})}$<1,故D正确;
故选D.
点评 本题考查微粒半径的比较,难度不大,明确原子及离子半径的比较方法是解题的关键,侧重于考查学生的分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
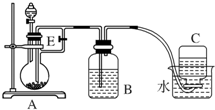 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )| A. | B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 | |
| B. | 实验开始时应先将活塞E关闭 | |
| C. | 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 | |
| D. | 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
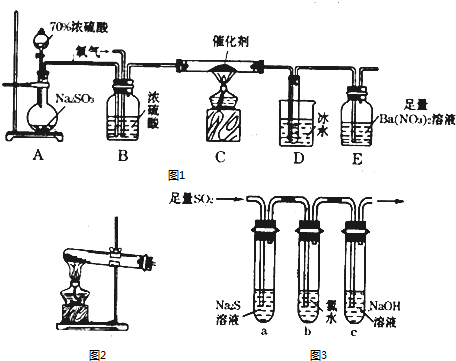
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
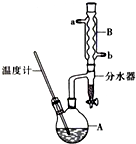 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
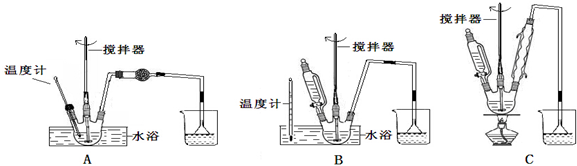
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
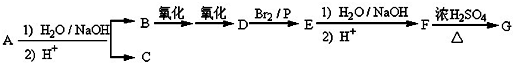

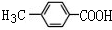 .
.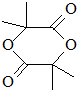 .
.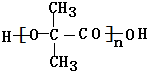 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
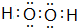 ,其中中心原子的杂化方式为sp3.
,其中中心原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com