
对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是( )
①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小。
A.①②③⑤ B.①②③④⑤ C.③⑤ D.①②③
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:2016届内蒙古高三上学期期中化学试卷(解析版) 题型:选择题
下列说法错误的是( )
A、二氧化硅用于制备太阳能电池板
B、氯气可用于自来水杀菌消毒
C、从海水中提取物质不一定必须通过化学反应才能实现
D、氢氟酸不能保存在玻璃瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
下列表述中合理的是
A.在101kPa下,1g物质完全燃烧所放出的热量叫做该物质的热值
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.太阳能电池是把太阳能转化为内能的装置
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A. 在测定中和热的实验中, 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
B. 酸碱中和滴定实验中,锥形瓶要用待装液预先润洗
C. 在测定中和热的实验中,用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D. 测溶液PH值时,PH试纸不能润湿
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.正反应是放热反应的可逆反应,升高温度v(正)>v(逆)
B.加压可使速率加快,是因为增加活化分子百分数而使反应速率加快
C.活化分子的碰撞不一定都能发生化学反应
D.催化剂可改变反应进程,故加催化剂改变了一个反应的 △H
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
【化学——选修物质结构与性质】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于 区,单质X的晶体类型为 ,其中X原子的配位数为 。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为 ,其同周期元素中,第一电离能最大的是________________(写元素符号)。元素Y的含氧酸中,酸性最强的是_____________(写化学式),该酸根离子的立体构型为_____________。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(5)X与Y形成的一种化合物的立方晶胞如图所示。
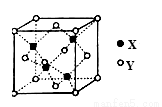
该化合物的化学式为_______________,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是 cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
下列离子方程式书写不正确的是
A.碳酸钠与次氯酸反应:CO32-+2HClO=2ClO-+H2O+CO2↑
B.二氧化硫通入次氯酸钠溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O
C.明矾溶液中加氢氧化钡溶液至硫酸根恰好沉淀完全:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.碘化亚铁溶液与少量氯气反应:2I-+Cl2=I2+2Cl-
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:填空题
工业上可以利用废气中的CO2为原料制取甲醇。请回答下列问题:
(1) 已知常温常压下,下列两个可逆反应的能量变化如下图所示:
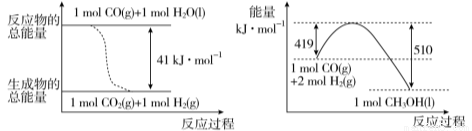
请写出左图反应的平衡常数表达式K= 。
请写出由二氧化碳和氢气制备甲醇的热化学方程式 。
(2) 如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先减小后增大
(3) 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填字母)。
A.H2的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时,n(H2)/n(CH3OH)增大
(4) 保持温度和体积不变,通入1molCO2和3molH2 ,下列能说明该反应已达平衡状态的是________(填字母)。
,下列能说明该反应已达平衡状态的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CO2的消耗速率之比为3∶1
D.容器内气体的平均相对分子质量保持不变
(5) 若反应容器的容积为2.0 L,反应时间4.0 min,容器 内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
(6) 有人设计甲醇-空气燃料电池电源, 用石墨作电极电解200 mL含有下列离子的溶液:
用石墨作电极电解200 mL含有下列离子的溶液:
离子 | Cu2+ | H+ | Cl- | SO |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为____________(忽略溶液体积的变化及电极产物可能存在的溶解现象)。也有人用此电源利用电解法制备Na2FeO4,阳极材料为铁,其电解质溶液用NaOH溶液,阳极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 1?己醇的沸点比己烷的沸点高 | 1?己醇和己烷可通过蒸馏初步分离 |
B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
C | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com