
【题目】对如表实验现象或操作的解释或结论错误的是![]()
编号 | 现象或操作 | 解释或结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入 |
|
B | 在 | 盐类水解反应是吸热反应 |
C | 向少量火柴头的浸泡溶液中滴加 | 火柴头里含有氯元素 |
D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
A.AB.BC.CD.D
【答案】A
【解析】
![]() 氯气能氧化碘离子生成碘,碘具有氧化性、二氧化硫具有还原性,二氧化硫能还原碘生成碘离子,所以该实验体现二氧化硫还原性而不是漂白性,故A错误;
氯气能氧化碘离子生成碘,碘具有氧化性、二氧化硫具有还原性,二氧化硫能还原碘生成碘离子,所以该实验体现二氧化硫还原性而不是漂白性,故A错误;
B.强碱弱酸盐溶液呈碱性,向强碱弱酸盐溶液中加入酚酞试液,溶液碱性越强,溶液的颜色越深,该实验加热后颜色加深,说明盐类水解为吸热反应,故B正确;
C.火柴头中含有![]() ,检验氯元素,应把
,检验氯元素,应把![]() 还原为
还原为![]() ,酸性条件下,
,酸性条件下,![]() 具有还原性,向少量的火柴头浸泡液中滴加
具有还原性,向少量的火柴头浸泡液中滴加![]() 、稀
、稀![]() 和
和![]() ,发生的离子反应为:
,发生的离子反应为:![]() ,出现白色沉淀,证明含有氯元素,故C正确;
,出现白色沉淀,证明含有氯元素,故C正确;
D.蒸馏时,温度计测量馏分温度,则蒸馏时温度计的球泡应靠近蒸馏烧瓶支管口处,此位置指示的是馏出物的沸点,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:

其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0

(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。

(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目前我国通过监测 6 项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2 和 CO 是其中 3 项中的污染物。
(1)一定温度下,向固定体积为 2 L 的密闭容器中充入 SO2 和 NO2 各 1 mol,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
(2)甲醇日趋成为重要的有机燃料,通常利用 CO 和 H2 合成甲醇,其反应的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

①上述合成甲醇的反应为__________反应(填“放热”或“吸热”)。
②A、B、C 三点的平衡常数 KA、KB、KC 的大小关系为__________。A、B 两点对应的压强大小关系是 PA__________PB(填“大于”、 “小于”或“等于”)。
(3) 若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为____________,理论上通过外电路的电子最多为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-定体积的某密闭容器中发生合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
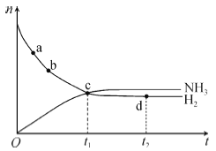
A.a点的正反应速率大于b点的
B.c点处,υ正(N2)=υ逆(N2)
C.d点处,υ正(N2):υ逆(H2)=1:3
D.升高温度,反应至t2时刻,n(H2)比图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.浓度相同的![]() 溶液和
溶液和![]() 溶液中
溶液中![]() 化学性质相同
化学性质相同
B.等质量的红磷和白磷完全燃烧生成![]() 放出热量相同
放出热量相同
C.可以通过化学反应将淀粉转化为乙酸
D.同温下,等体积pH相同的![]() 溶液和HCl溶液中由水电离出的
溶液和HCl溶液中由水电离出的![]() 数目相同
数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案、现象与实验结论不正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 向 产生白色沉淀 |
|
B | 向 浅绿色变深绿色 | 溶液中存在 |
C | 向沸水中滴加 | 该液体分散质直径介于1nm与100nm之间 |
D | 向 |
|
A.AB.BC.C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A.向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图。CH3COOH![]() H++CH3COO-
H++CH3COO-

B.向FeCl3溶液和KSCN溶液混合后反应达平衡后, 向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图。FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl

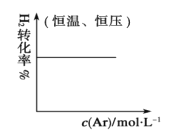
C.密闭容器中进行N2(g)+3H2(g) ![]() 2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图。
2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图。
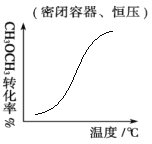
D.密闭容器中进行CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) ΔH>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图。
6H2(g)+2CO2(g) ΔH>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是________
2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是________
A.混合气体的密度不再变化
B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的百分含量不再变化
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol- 1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:________________________。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式________________;
②计算上述反应T1℃时的平衡常数K1=________;若T1<T2,则该反应的△H_______0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不具有因果关系的是( )
A. 明矾溶于水后生成氢氧化铝胶体,因此具有净水能力
B. 纯碱水溶液呈碱性,因此可以去油污
C. 二氧化硅与氢氧化钠溶液反应生成硅酸钠,因此装氢氧化钠溶液的试剂瓶不能用玻璃塞
D. ![]() 具有漂白性,因此能使酸性高锰酸钾溶液褪色
具有漂白性,因此能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com