
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
【答案】C
【解析】t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,根据方程式生成n(CO2)=0.4mol,生成n(H2)= 0.4mol,反应在0--t1min内的平均速率为v(H2)= ![]() 0.20/t1 mol·L-1·min-1,故A错误;t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,消耗n(H2O)=0.4mol,t1min末n(H2O)=0.2mol,t2min末n(H2O)=0.2mol,所以可知t1min末反应达到平衡状态,平衡时CO的转化率为
0.20/t1 mol·L-1·min-1,故A错误;t1min末n(CO)=0.8mol,反应消耗n(CO)=0.4mol,消耗n(H2O)=0.4mol,t1min末n(H2O)=0.2mol,t2min末n(H2O)=0.2mol,所以可知t1min末反应达到平衡状态,平衡时CO的转化率为![]() 33.33%,故B错误;t1min末反应达到平衡状态,n(CO)=0.8mol、n(H2O)=0.2mol、n(CO2)=0.4mol、n(H2)=0.4mol,该温度下反应的平衡常数
33.33%,故B错误;t1min末反应达到平衡状态,n(CO)=0.8mol、n(H2O)=0.2mol、n(CO2)=0.4mol、n(H2)=0.4mol,该温度下反应的平衡常数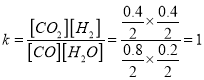 ,故C正确;若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.40mol,故D错误。
,故C正确;若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.40mol,故D错误。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是________(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是______(填元素符号)。
②下列物质中,具有抗菌消炎疗效的是________(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是__________,属于防腐剂的是________。

(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①水泥、玻璃及陶瓷都是传统的硅酸盐材料,生产水泥和玻璃都用到的原料是________;蓝色玻璃是在其中添加了氧化物________(写化学式);SiC是一种新型的陶瓷,工业上用石英砂与焦炭高温条件下生成SiC的同时的生成CO,该制备反应的化学方程式为_____________。
②钢铁制品在潮湿的空气中发生______(填“化学”或“电化学”)腐蚀是造成钢铁腐蚀的主要原因。硬铝(一种铝合金)是制造飞机和宇宙飞船的理想材料,和纯铝相比,硬铝强度________________(填“低”“高”或“无法确定”),具有较强的抗腐蚀能力。
③橡胶是制造轮胎的重要原料,天然橡胶通过________(填“硫化”“氧化”或“老化”)措施可增大其强度、弹性和化学稳定性等。
查看答案和解析>>
科目:高中化学 来源: 题型:
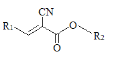
【题目】α-氰基烯酸酯类医用胶无毒无害、性质稳定、与生物组织粘合好,可用做手术伤口粘合剂。其分子结构可用如图所示的通式表示:
资料卡片:
①分子中 “—R1”部分碳链适当增长,有助于延长固化时间。
②分子中 “-R2”部分碳链增长,耐水性增强,更适合在水湿环境中粘合。
③分子中 “-R2”部分若再引入一个α-氰基烯酸酯的结构,则可发生交联聚合,使胶膜硬度、韧性均增强。
(1)502胶是应用最早的医用胶,主要成分是![]() 。
。
① 该分子中含有的官能团是氰基(—CN)、碳碳双键和_______。
② 该物质具有粘合性的原因是发生加聚反应(微量水蒸气作用下),化学方程式是_______。
③ 常温下,丙烯难以聚合,而502胶可以快速聚合。从分子结构的角度分析产生该差异的原因是_______。
(2)科学家已将502胶改良为504胶(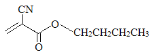 ),504胶相对502胶的优点是_______。
),504胶相对502胶的优点是_______。
(3)用于粘接骨骼的“接骨胶”固化时间不能太短,且粘合后强度要高。请设计一种 “接骨胶”,写出其主要成分的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的蔗糖(C12H22O11)放入烧杯中,滴入几滴水并搅拌均匀,然后再加入适量的浓硫酸,迅速搅拌,放出大量的热,同时观察到固体逐渐变黑。片刻后,黑色物质急剧膨胀,并产生大量刺激性气味的气体(实验过程如图所示)
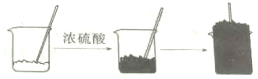
(1)固体变黑体现了浓硫酸的__________性。
(2)为了确定刺激性气味气体的成分,收集性所得气体,分别进行如下实验。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有_________。
②将气体通入澄清石灰水,溶液变浑浊,_________(填“能”或“不能”)证明气体中含有CO2,其理由为______(用离子方程式表示)。
③刺激性气味气体产生的原因可用化学方程式表示为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
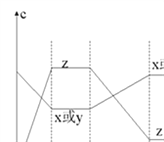
A. 增大X或Y的浓度 B. 增大压强
C. 增大Z的浓度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气(液氯)、84消毒液、漂白粉等都是含氯消毒剂。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为__________。
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为_______;该反应中氧化剂与还原剂的物质的量之比为________。
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为__________(要求写出简要计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
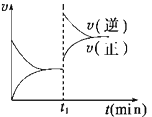
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
D. 2NH3(g)![]() N2(g)+3H2(g) ΔH>0
N2(g)+3H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用HF、Na2CO3和Al(OH)3制备冰晶石。化学反应原理是,2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2↑+9H2O.属于盐的有Na2CO3和_______。上述反应不能在玻璃容器中反应,其原因是________(用化学方程式表示)。
(2)明矾[KAl(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式____________。
(3)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等(同温同压)。则该合金中铁、硅的质量之比为______。(已知:Si+2NaOH+H2O=Na2SiO3+ 2H2↑)
(4)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式________________。
②在化学上,含氢还原剂的还原能力用“有效氢”表示,”有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法不正确的是
A. 分离器中的物质分离操作为蒸馏
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 反应器中消耗了碘,膜反应器中生成了碘,体现了“碘循环”
D. 碘循环工艺的总反应为SO2+2H2O=H2+H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com