
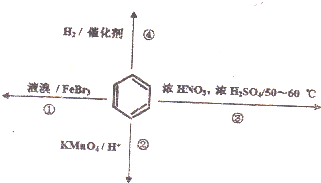
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应,产物是无色液体 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
分析 A.依据苯与液溴发生反应条件判断;
B.苯不含有碳碳双键,不能与高锰酸钾反应,二者混合发生萃取;
C.苯与浓硝酸在浓硫酸做催化剂条件下发生取代反应;
D.苯分子中不存在碳碳双键,能够与氢气发生反应,证明苯不属于饱和烃.
解答 解:A.常温下苯与液溴在溴化铁做催化剂条件下反应生成溴苯,故A错误;
B.苯不含有碳碳双键,不能与高锰酸钾反应,二者混合发生萃取,苯密度小于水的密度,所以出现分层现象,紫色层在下层,故B正确;
C.苯与浓硝酸在浓硫酸做催化剂条件下发生取代反应生成硝基苯,故C错误;
D.苯分子中的碳碳键为一种介于碳碳单键和碳碳双键之间的独特键,不存在碳碳双键;苯能够与氢气反应,只证明苯不属于饱和烃,故D错误;
故选:B.
点评 本题考查了苯的结构与性质,题目难度不大,注意掌握苯分子中碳碳键特点,明确苯具有的化学性质,能够正确书写苯与液溴、氢气等反应的化学方程式.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
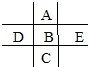 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .A单质的电子式为
.A单质的电子式为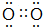 .
.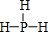 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
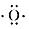 ;D原子的结构示意图
;D原子的结构示意图 .
.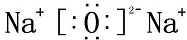 ,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.
,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烯共1 mol,完全燃烧后生成2mol H2O | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种 | |
| C. | 乙烯可以用作生产食品包装材料的原料 | |
| D. | 乙烷室温下能与浓盐酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
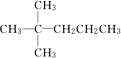 .
. 、
、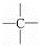 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: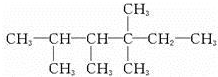
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com