
 如图所示,把试管放入盛有25度时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题.
如图所示,把试管放入盛有25度时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题.分析 镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答.
解答 解:(1)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为:①镁片逐渐溶解②镁片上有大量气泡产生③烧杯中析出晶体,
故答案为:镁片逐渐溶解,镁片上有大量气泡产生,烧杯中析出晶体;
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体,
故答案为:镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中溶解度水温度升高而减小,故析出Ca(OH)2晶体;
(3)反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量,
故答案为:小于.
点评 本题通过镁与盐酸的反应,考查了放热反应、氢氧化钙溶解度特点,题目难度不大,注意对基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
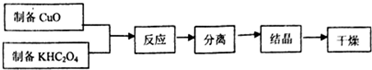
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
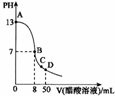 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共七个横行代表七个周期,18个纵行代表18个族 | |
| D. | 主族元素原子的最外层电子数等于该元素所属的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 临氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: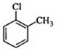 CH2Cl-CH2Cl CH2Cl-CH2Cl 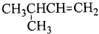 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现五组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
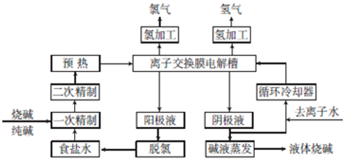
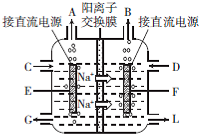
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | A、L、M三元素的金属性逐渐增强 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | A在T单质中燃烧所形成的化合物中含有共价键和离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com