
(1)查数据得到Ksp(BaSO4)≈1×10-10,Ksp(BaCO3)≈5×10-9,若向BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO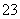 )=________mol·L-1时,BaSO4开始向BaCO3沉淀转化。
)=________mol·L-1时,BaSO4开始向BaCO3沉淀转化。
(2)在25℃时某一元酸HA的电离平衡常数Ka=1×10-8,相同物质的量浓度的HA和NaA两溶液等体积混合后,溶液pH_____7(填“<”、“>”或“=”)。
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.由于氧化性HNO3大于H2SO4,所以非金属性:氮大于硫
B.科学家在金属和非金属交界线处寻找催化剂
C.只有主族元素是由短周期和长周期元素共同构成的
D.长周期主族元素X的阳离子X2+的最外层有2个电子,则它是IVA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
A.曲线I中滴加溶液到10 mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:
c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各式中,属于正确的电离方程式的是
A.HCO3- + H2O  H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O  NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度条件下,下列有关一定物质的量浓度的氨水说法正确的是
A.氨水促进了水的电离 B. 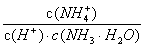 是个常数
是个常数
C.NH3·H2O电离达到平衡的标志是溶液呈电中性
D.c(NH )+c(H+)=c(NH3·H2O)+c(OH-)
)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
C.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO-
D.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,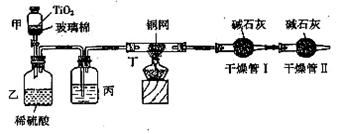 先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.2 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
__________(填“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是
A.C(s石墨)= C(s金刚石)△H= +1.9 kJ•mol-1
B.金刚石的稳定性大于石墨
C.石墨和金刚石转化是物理变化
D.1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体
B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性
C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com