
ˮ��Һ�д��ڶ���ƽ�⣬��ش��������⡣
��1�������м�����Һ��a. NH3��H2O b. CH3COONa c. NH4Cl d. NaHSO4
�����³����Ե���Һ�� (�����)��
��2����֪NaHCO3��Һ�ʼ��ԣ�����Һ�г�ˮ�ĵ��������������ƽ�⣬�õ��뷽��ʽ�����ӷ���ʽ��ʾ�� ��
������Һ�е�����Ũ���ɴ�С��˳���ǣ� ��
��3����Ũ�Ⱦ�Ϊ0.1 mol?L-1�� �����������۴���������Һ�����������գ�
������Һ��c(H+)��С˳��Ϊ ���к�һ����NaOH��Һ��������ʱ���������������������εĴ�С��ϵΪ ����������Һ��pH��Ϊ2���ֱ�ȡ10mL������Һ��ˮϡ����1000mL,��ʱ������Һ��pH�Ĵ�С��ϵΪ ��
��4��25��ʱ��AgCl��Ksp=1.8��10-10 ����д��AgCl�ܽ�ƽ��ı���ʽ�� ���ֽ�����AgCl����Ͷ��100mL0.1mol/L MgCl2��Һ��ֽ������ȴ��25��ʱ����ʱc(Ag��)= mol/L��������Һ����ı仯����
��18�֣���ÿ�ո�2�֣���1��c.d ��2��HCO3- H++CO32- HCO3-+H2O
H++CO32- HCO3-+H2O H2CO3 ��OH�� c(Na+)>c(HCO32��)>
c(OH��) > c(H+) > c(CO32-)
H2CO3 ��OH�� c(Na+)>c(HCO32��)>
c(OH��) > c(H+) > c(CO32-)
��3����>��>�� ��=��>�� ��=��>��
��4��AgCl(S)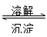 Ag+(aq)+Cl-(aq) 9��10-10
Ag+(aq)+Cl-(aq) 9��10-10
��������
�����������1����ˮ�������Һ�Լ��ԡ�����������ˮ��CH3COO������ˮ�⣬��Һ�Լ��ԡ��Ȼ������ˮ��NH4������ˮ�⣬��Һ�����ԡ����������Σ�����ˮ����ȫ����������ӣ���Һ�����ԣ���ѡcd��
��2��̼���������������ʽ�Σ�����HCO3-��ˮ��ƽ�⣬Ҳ��HCO3-�ĵ���ƽ�⣬�йص����ӷ���ʽ��HCO3- H++CO32-��HCO3-+H2O
H++CO32-��HCO3-+H2O H2CO3 ��OH��������ˮ��̶ȣ����ڵ���̶ȣ�������Һ�Լ��ԣ��й�����Ũ�ȵĴ�С��ϵ��c(Na+)>c(HCO32��)>
c(OH��) > c(H+) > c(CO32-)��
H2CO3 ��OH��������ˮ��̶ȣ����ڵ���̶ȣ�������Һ�Լ��ԣ��й�����Ũ�ȵĴ�С��ϵ��c(Na+)>c(HCO32��)>
c(OH��) > c(H+) > c(CO32-)��
��3��������һԪȱ�٣������Ƕ�Ԫǿ�ᣬ������һԪ���ᣬ���������ʵ���Ũ����ȵ������£�������Һ��c(H+)��С˳��Ϊ��>��>�ۣ��к�һ����NaOH��Һ��������ʱ���������������������εĴ�С��ϵΪ��=��>�ڣ���ϡ�����У������ڼ�������������ӣ�����ϡ�ͺ�������Һ��pH�Ĵ�С��ϵΪ��=��>�ۡ�
��4��AgCl�ܽ�ƽ��ı���ʽΪAgCl(S) Ag+(aq)+Cl-(aq)����Һ�������ӵ�Ũ����0.2mol/L��������Ȼ������ܶȻ�������֪����Һ��c(Ag��)��
Ag+(aq)+Cl-(aq)����Һ�������ӵ�Ũ����0.2mol/L��������Ȼ������ܶȻ�������֪����Һ��c(Ag��)��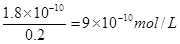
���㣺������Һ����Ե��жϡ�̼�����Ƶ�ˮ��͵��롢������ʵĵ���ƽ���Լ��ܶȻ��������йؼ����Ӧ��
�������������е��Ѷȵ����⣬����ע�ػ�����֪ʶ�ļ����̡����⿼���֪ʶ��ȽϷ�ɢ����Ҫ��Χ��������ʵĵ���ƽ����ܽ�ƽ��չ���ģ�����������ѧ������˼ά�����ͷ�ɢ˼ά���������ѧ���������⡢���ɡ��ܽ������������


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���ϣ���H2S������ˮ��Լ1��2������ˮ��ҺΪ��Ԫ���ᣮ ��H2S��������������ӷ�Ӧ���ɳ����� ��H2S�ڿ�����ȼ�գ�����ʵ���ɫ�� |

| ʵ����� | ʵ������ | |
| ʵ��1 | ����Ũ�ȵ�Na2S��Na2SO3��Һ�������2��1��� | ���������� |
| ʵ��2 | ��H2Sͨ��Na2SO3��Һ�� | δ�����Գ������ټ�������ϡ���ᣬ������������dz��ɫ���� |
| ʵ��3 | ��SO2ͨ��Na2S��Һ�� | ��dz��ɫ�������� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ͨ��ʵ��ⶨ��Ӧ���ʵķ����ж��֣�Ϊ֤����ѧ��Ӧ�����뷴Ӧ��Ũ���йأ���ͬѧ�������ʵ�飺
ͨ��ʵ��ⶨ��Ӧ���ʵķ����ж��֣�Ϊ֤����ѧ��Ӧ�����뷴Ӧ��Ũ���йأ���ͬѧ�������ʵ�飺| ��� | Na2S2O3��Һ | ϡH2SO4 | ���ֻ���ʱ�� | ||
| Ũ�� | ���� | Ũ�� | ���� | ||
| ��1�� | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| ��2�� | 0.1mol?L-1 | 10mL+5mL ˮ | 0.1mol?L-1 | 10mL | t2 |
| ��3�� | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mLˮ | t3 |
| ��4�� | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013���������������ʮ����ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
ˮ��Һ�д��ڶ���ƽ�⣬��ش��������⡣
��1�������м�����Һ��a. NH3��H2O b. CH3COONa c. NH4Cl d. NaHSO4
�����³����Ե���Һ�� (�����)��
��2����֪NaHCO3��Һ�ʼ��ԣ�����Һ�г�ˮ�ĵ��������������ƽ�⣬�õ��뷽��ʽ�����ӷ���ʽ��ʾ�� ��
������Һ�е�����Ũ���ɴ�С��˳���ǣ� ��
��3����Ũ�Ⱦ�Ϊ0.1 mol?L-1�� �����������۴���������Һ�����������գ�
������Һ��c(H+)��С˳��Ϊ ���к�һ����NaOH��Һ��������ʱ���������������������εĴ�С��ϵΪ ����������Һ��pH��Ϊ2���ֱ�ȡ10mL������Һ��ˮϡ����1000mL,��ʱ������Һ��pH�Ĵ�С��ϵΪ ��
��4��25��ʱ��AgCl��Ksp=1.8��10-10 ����д��AgCl�ܽ�ƽ��ı���ʽ�� ���ֽ�����AgCl����Ͷ��100mL0.1mol/L MgCl2��Һ��ֽ������ȴ��25��ʱ����ʱc(Ag��)= mol/L��������Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ĵ�ʡ��ɽ�ݸ����ڶ�������Բ������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
2012��10��8�շ��������桶��������ʻ֤�����ʹ�ù涨���������Υ�¼�ʻԱ�������ͷ������dz�Ϊ��ʷ�����Ͻ��桱���������ƺ��ʻ��������һ�μ�12�֡��������²��Թܿɼ��˾���Ƿ�ƺ�ݳ�����ѧԭ�����£�

�������ڻ���������Ҫ��+3�ۺ�+6�����ּ�̬��+6�۸�������K2CrO4��K2Cr2O7��ˮ��Һ�зֱ�ʻ�ɫ�ͳ�ɫ����������Һ�д�������ƽ���ϵ��2CrO42-+2H+ Cr2O72-+H2O������������+6�۸����������ǿ�����ԣ����Խ�C2H5OH����ΪCH3COOH����������ԭΪCr3+��Cr3+��ˮ��Һ�гʻ���ɫ��
Cr2O72-+H2O������������+6�۸����������ǿ�����ԣ����Խ�C2H5OH����ΪCH3COOH����������ԭΪCr3+��Cr3+��ˮ��Һ�гʻ���ɫ��
��1����������������֪����ǿ����������+6�۸���Ҫ�� ���CrO2-4����Cr2O2-7������ʽ���ڡ����˾���ƺ�ݳ�������Թ��е������� �ҳ������������ߣ���Ӧ�����ӷ���ʽΪ ��
��2���о�����+6�۸��Ķ���Ϊ+3�۸��Ķ��Ե�100��200�����ж��ַ������Խ���ˮ�е�+6�۸�ת��Ϊ+3�۸��Խ��Ͷ��ԡ��������ַ������£�
����һ���绯ѧ����������Cr2O2-7�����Է�ˮ������NaCl������Ȳ���Fe���缫���е�⡣������������Fe2+��Cr2O2-7��ԭΪCr3+���ڵ���������Һ��pH��������������Cr3+��Fe3+��Cr��OH��3��Fe��OH��3��������ʽ������
���������ҺpH����������ԭ�� ��
����֪Fe3+��Cr3+��ΪFe��OH��3��Cr��OH��3������pH���±���

����Һ��pH��ΧΪ____ʱ����Һ��Fe3+�ѳ�����ȫ��Cr3+��û�п�ʼ������
�۵���·��ͨ��3mol����ʱ�����ۿɻ�ԭCr2O2-7�����ʵ���Ϊ mol��
����������ԭ����������l0mlij������Cr2O2-7����ˮ�����������[FeSO4��(NH4)2SO4��6H2O]��������Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ�������ó����������ΪnmolFeO��FeyCrxO3��
�ܲ����Ǵ��������е�ʵ����ģ����������������
A����Ӧ�з���ת�Ƶĵ��Ӹ���Ϊ3nx
B���÷�ˮ��c��Cr2O2-7��Ϊ50nx mol/L
C��������������淋����ʵ���Ϊn��l+y��mol
D����FeO��FeyCrxO3��x+y=2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com