
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CaCO3═Ca2++CO2↑+H2O |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下22.4LH2中含有的氢分子的个数为NA |
| B、1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
| C、凡是溶于水能导电的化合物就是电解质 |
| D、某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验 | 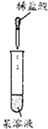 | 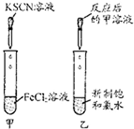 |  | 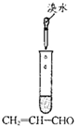 |
| 现象 | 出现白色沉淀 | 甲、乙中溶液均未变红 | 苯中不褪色,甲苯在褪色 | 溶液褪色 |
| 结论 | 原溶液可能含Ag+或SiO32- | 氯水可能氧化SCN- | 甲苯中甲基易被氧化 | 可证明分子中含碳碳双建 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加碳酸钠固体的量 |
| B、盐酸的量增加一倍 |
| C、盐酸的用量加倍浓度减半 |
| D、温度升高40℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g氧气和28g CO和N2的混合气体,含为原子数目相等 |
| B、等物质的量浓度的盐酸和硫酸,H+的物质的量浓度相等 |
| C、在常温常压下,11.2L氯气的分子数为0.5NA |
| D、把40g NaOH固体溶于1L水中,所得NaOH溶液的物质的量浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Ag、Mg |
| B、Al、Cu、Mg、Ag、Fe |
| C、Mg、Cu、Al、Ag、Fe |
| D、Mg、Ag、Al、Cu、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com