
分析 缩小体积,平衡向正反应方向移动,设转化xmol氧气,则
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
转化:2x x 2x
平衡:0.8 1.4
原平衡时,n(SO2):n(O2):n(SO3)=2:3:4.则(x+0.8):(1.4-2x)=3:4,可知x=0.1,以此计算SO2的物质的量并计算平衡常数.
解答 解:缩小体积,平衡向正反应方向移动,设转化xmol氧气,则
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
转化:2x x 2x
平衡:0.8 1.4
原平衡时,n(SO2):n(O2):n(SO3)=2:3:4.则(x+0.8):(1.4-2x)=3:4,可知x=0.1,
(1)x=0.1,则原平衡时n(O2)=0.9mol,n(SO3)=1.2mol,n(SO2):n(O2)=2:3,则原平衡时n(SO2)=0.6mol,而转化0.2mol,则达到新平衡时二氧化硫的物质的量为0.6mol-0.2mol=0.4mol,
答:此时SO2的物质的量应是0.4mol;
(2)若体积为2L,此时c(SO2)=0.2mol/L,c(O2)=0.4mol/L,c(SO3)=0.7mol/L,
则K=$\frac{0.{7}^{2}}{0.{2}^{2}×0.4}$=30.625,
答:该温度下的该反应的平衡常数为30.625.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,注意把握计算的思路.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
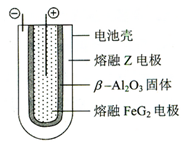 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质有氧化性 | B. | 二氧化硫具有还原性 | ||
| C. | 硫酸可以被氧化 | D. | 硫化氢(H2S)可以被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
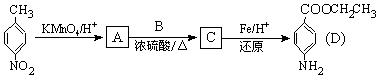
 、BCH3CH2OH、C
、BCH3CH2OH、C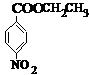 .
.
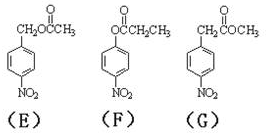
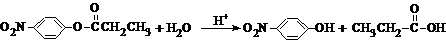 .
.

 的流程图(无机试剂任选).合成路线流程图示如图:
的流程图(无机试剂任选).合成路线流程图示如图:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液中加盐酸 CO32-+2H+═CO2和H2O | |
| C. | 氢氧化钠溶液中加硫酸镁 2OH-+Mg2+═Mg(OH)2 | |
| D. | 氢氧化钡溶液中加硫酸 OH-+H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com