
 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.分析 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,其基态原子的电子排布式为[Ar]3d54s1;
(2)图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,A以及前面的2种单质的沸点都低于0℃,则连续3种均为气体单质,根据周期表分析;
(3)元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小;同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(4)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;根据碳原子成键类型判断;
(5)氢键结合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素.
解答 解:(1)与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,其基态原子的电子排布式为[Ar]3d54s1,
故答案为:[Ar]3d54s1;
(2)图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,A以及前面的2种单质的沸点都低于0℃,则连续3种均为气体单质,在周期表中,连续出现气体单质的为第二周期的N、O、F,所以A为第三种气体单质,则为F2;
故答案为:F2;
(3)同一周期元素从左到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P;元素C、N、O、F属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是F>N>O>C,
故答案为:F;C;
(4)根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,
根据图可知,碳碳间形成单键,为sp3杂化,有的碳碳间形成双键,为sp2杂化,故答案为:abcd;sp2;sp3.
(5)在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键,
故答案为:在HF${\;}_{2}^{-}$(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子.
点评 本题考查比较综合,涉及周期表的应用,杂化方式的判断、化学式的书写以及氢键的形成条件及表示方法,难度不大.


科目:高中化学 来源: 题型:多选题
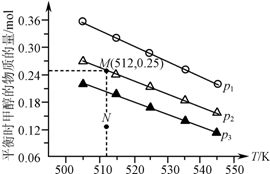 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2A溶液中:c(Na+)>c(A2-)>c (HA-)>c(H2A) | |
| B. | NaHA溶液中:c(Na+)=c(A2-)+c(HA-) | |
| C. | Na2A溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 室温下0.1mol/L的H2A溶液pH大于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.
将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水中存在c(H+)>c(Cl-)=c(HClO)+c(ClO-) | |
| B. | 25℃时,H++ClO-?HClO的平衡常数K=1.0×10-7.5 | |
| C. | 氯气处理饮用水时,pH=5.5的效果比pH=7.5的好 | |
| D. | 新制的氯水中存在c(H+)═c(Cl-)+c(ClO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A. | 所用HCl的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L-1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | A.B.C三点水的电离程度大小依次为:A>B>C | |
| D. | 滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子中有两个碳原子 | |
| B. | 乙酸分子是由一个乙基和一个羧基构成 | |
| C. | 乙酸分子的官能团是羧基 | |
| D. | 乙酸分子中含有一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
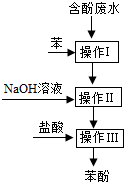
| A. | 操作I中苯作萃取剂 | |
| B. | 苯酚钠在苯中的溶解度比在水中的大 | |
| C. | 通过操作II苯可循环使用 | |
| D. | 三步操作均需要分液漏斗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com