
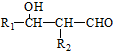
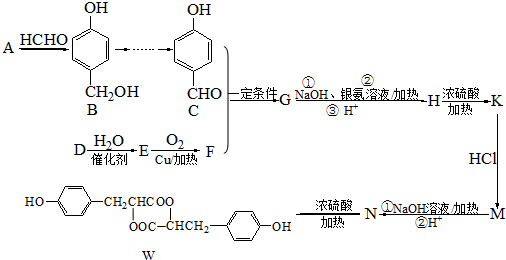
 .
.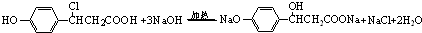 .
.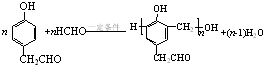 .
.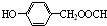 .
. 分析 有机物D是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则D为CH2=CH2,与水发生加成反应生成E为CH3CH2OH,CH3CH2OH发生氧化反应得F为CH3CHO,F与对羟基苯甲醛发生信息中的反应生成G为 ,G发生银镜反应然后酸化生成H为
,G发生银镜反应然后酸化生成H为 ,H在浓硫酸作催化剂、加热条件下发生消去反应生成K为
,H在浓硫酸作催化剂、加热条件下发生消去反应生成K为 ,结合W的结构逆推可知,K与氯化氢发生加成反应生成M为
,结合W的结构逆推可知,K与氯化氢发生加成反应生成M为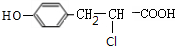 ,M发生水解反应生成N为
,M发生水解反应生成N为 ,N在浓硫酸作催化剂、加热条件下发生酯化反应生成W,A和甲醛反应生成对羟基苯甲醇,结合A分子式知,A为苯酚,据此分析解答.
,N在浓硫酸作催化剂、加热条件下发生酯化反应生成W,A和甲醛反应生成对羟基苯甲醇,结合A分子式知,A为苯酚,据此分析解答.
解答 解:有机物D是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则D为CH2=CH2,与水发生加成反应生成E为CH3CH2OH,CH3CH2OH发生氧化反应得F为CH3CHO,F与对羟基苯甲醛发生信息中的反应生成G为 ,G发生银镜反应然后酸化生成H为
,G发生银镜反应然后酸化生成H为 ,H在浓硫酸作催化剂、加热条件下发生消去反应生成K为
,H在浓硫酸作催化剂、加热条件下发生消去反应生成K为 ,结合W的结构逆推可知,K与氯化氢发生加成反应生成M为
,结合W的结构逆推可知,K与氯化氢发生加成反应生成M为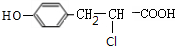 ,M发生水解反应生成N为
,M发生水解反应生成N为 ,N在浓硫酸作催化剂、加热条件下发生酯化反应生成W,A和甲醛反应生成对羟基苯甲醇,结合A分子式知,A为苯酚,
,N在浓硫酸作催化剂、加热条件下发生酯化反应生成W,A和甲醛反应生成对羟基苯甲醇,结合A分子式知,A为苯酚,
(1)W中含有的官能团名称是酯基和羟基,故答案为:酯基;羟基;
(2)G的结构简式是 ,故答案为:
,故答案为: ;
;
(3)A发生加成反应生成B,H发生消去反应生成K,故答案为:加成反应;消去反应;
(4)K与氯化氢发生加成反应生成M1为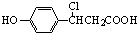 ,在加热条件下M1与足量稀NaOH溶液水溶液在加热条件下反应的化学方程式为
,在加热条件下M1与足量稀NaOH溶液水溶液在加热条件下反应的化学方程式为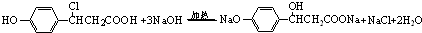 ,
,
故答案为: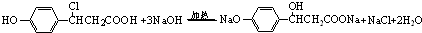 ;
;
(5)B与HCHO在一定条件下反应的化学方程式为 ,
,
故答案为: ;
;
(6)G的同系物I比G相对分子质量小14,则I比G中少一个C原子,G为 ,I的同分异构体中能同时满足如下条件:
,I的同分异构体中能同时满足如下条件:
①与FeCl3溶液反应,溶液呈紫色,说明含有酚羟基;
②能发生水解反应,说明含有酯基;
③能发生银镜反应,说明含有醛基,应该为甲酸酯,
如果取代基为-OH、HCOOCH2-,有邻间对3种结构;
如果取代基为-OH、HCOO-、-CH3,
如果-OH、HCOO-为邻位,有4种结构;
如果-OH、HCOO-为间位,有4种结构;
如果-OH、HCOO-为对位,有2种结构;
则符合条件的有13种;
I的一种同分异构体的核磁共振氢谱有五组峰,且峰面积比为1:2:2:2:1,I的这种同分异构体的结构简式为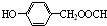 ,
,
故答案为:13;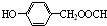 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断及知识综合运用能力,正确理解醛之间的加成反应断键成键特点是解本题关键,根据反应条件、某些物质结构简式进行推断,难点是(6)题限制型同分异构体种类判断,题目难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:推断题
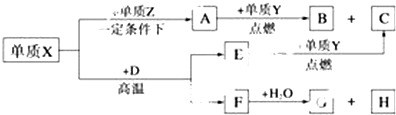
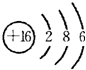 ,A的电子式
,A的电子式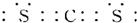 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
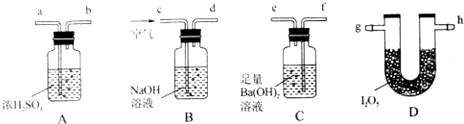
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
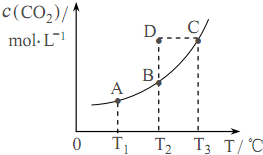 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以漂白纸浆和草帽辫 | |
| B. | 单质硅可用做半导体材料 | |
| C. | 小苏打可作食品的膨松剂 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
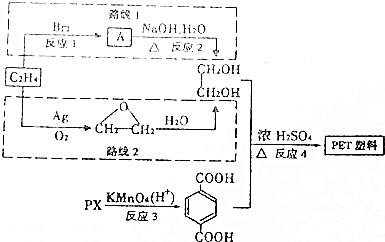

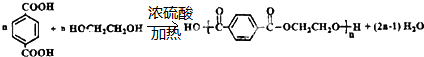 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
某溶液中含有大量的Cl-、CO32-、SO42-等三种阴离子。如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加HNO3溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A. ①④②③ B. ④②①③ C. ③②①④ D. ④②③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com