
已知:① Fe2O3(s)+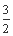 C(s)
C(s)
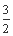 CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1
CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1
②C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
则Fe(s)与O2反应生成Fe2O3的热化学方程式是
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑ + H2O B.2H2O2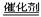 2H2O+O2↑
2H2O+O2↑
C.CaO+H2O=Ca(OH)2 D.CaCO3 CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲探究食品添加剂铵明矾NH4Al(SO4)2·12H2O高温分解的情况。
(1)预测产物:下列关于气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)定性检验:取一定量铵明矾,设计下列实验探究产物 。
①按图示组装仪器后,首先检查整套装置的气密性,操作是________。
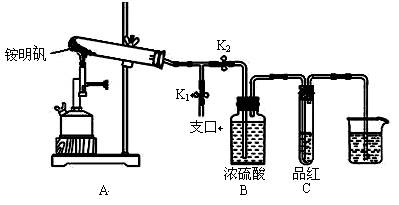
②夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是_________(任填一种物质的化学式)。
③分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式。
④为了防止倒吸,实验结束时必须先____________(填字母序号),然后熄灭酒精喷灯。
A.取出烧杯中的导管 B.打开止水夹K1 C.关闭止水夹K2
(3)分析和结论:实验证明气体产物是(1)D中的5种气体。相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水溶液中能大量共存的一组离子是 ( )
A.Ca2+、Al3+、Br-、CO3- B.Pb2+、Hg2+、S2-、SO3-
C. N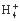 、H+、S2
、H+、S2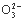 、P
、P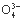 D.Na+、Ba2+、Cl-、NO3-
D.Na+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是 ( )
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
| B | 用pH=1的盐酸配制100 mL,pH=2的盐酸 | 100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较Br2与I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. 图中A-J均为有机化合物,根据图中的信息,回答下列问题:
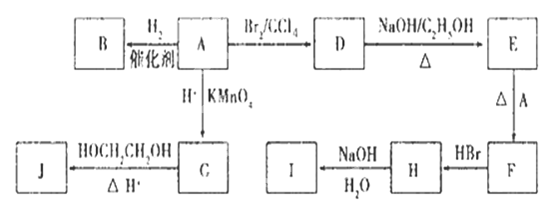
(1)环状化合物A的相对分子质量为82,其中含碳87. 80%,含氢12. 20%。B的一氯代物仅有一种,B的结构简式为 ;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 ;
(3)由A生成D的反应类型是___________,由D生成E的反应类型是_______ _____;
(4)(3分)C的分子式为C6H10O4,0.146 g G需用20 mL0.100 mol/L NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为:
_______ ___
(5)H中含有的官能团是(名称)________,I中含有的官能团是(名称)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀 切开观察。在这一实验过程中不能得出的钠的物理性质是
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里需要用500mL 0.03 mol·L-1的硫酸铜溶液。
试回答该溶液配制过程中的下列问题:
实验试剂及仪器:硫酸铜晶体、蒸馏水、烧杯、天平、药匙、胶头滴管、量筒。
(1)实验还缺少的仪器有: 。
(2)所需的硫酸铜晶体质量为: g。
(3)下列对容量瓶及其使用方法的描述正确的是:( )
a.使用前要检查容量瓶是否漏水
b.容量瓶上标明了规格、温度和浓度
c.容量瓶用蒸馏水洗净后,再用标准硫酸铜溶液润洗
d.配制溶液时,将称好的硫酸铜晶体小心倒入容量瓶,加蒸馏水至距刻度线1~2cm
(4)下图是某同学配制该0.01 mol·L-1的硫酸铜溶液的过程示意图。请你观察图示判断其中不正确的操作有 (填序号);如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,该同学所配制的硫酸铜溶液的浓度将
(填“偏大”或“偏小”或“无法确定”)。
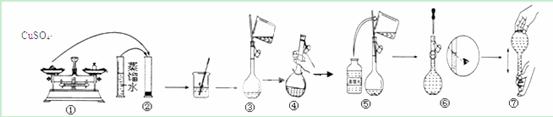
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ•mol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.其它条件不变的情况下,加入催化剂可提高CO的转化率
D.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,
c(CH3OH)=2 mol/L,则a=5.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com