
 .
.
分析 (1)H2O2的结构式为H-O-O-H,存在两对共用电子对;
(2)①通入潮湿的CO2却可以产生O2,与碳酸反应生成过氧化氢,然后分解生成氧气;
(3)①Cu失去电子,被过氧化氢氧化;
②CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,Cu元素的化合价降低,则S元素的化合价升高;
③CuSO4溶液与NaCl、Cu粉、盐酸在加热条件反应得到[CuCl3]2-,过滤分离出未反应的Cu,滤液中含有CuCl3]2-,在水溶液中存在平衡:CuCl(白色)+2Cl-?[CuCl3]2-(无色溶液),加入水进行稀释,有利于CuCl沉淀的生成,再经过过滤分离,洗涤干燥得到CuCl.
a、加热可以加快反应速率,由于硫酸铜溶液为蓝色,而[CuCl3]2-为无色溶液,根据溶液颜色变化判断反应已经完全;
b、潮湿的CuCl在空气中易发生水解和氧化,开始加入的浓盐酸及用酒精洗涤均可以抑制水解,在真空中干燥,不能与空气接触.
解答 解:(1)H2O2的结构式为H-O-O-H,存在两对共用电子对,其电子式为 ,
,
故答案为: ;
;
(2)通入潮湿的CO2却可以产生O2,与碳酸反应生成过氧化氢,然后分解生成氧气,发生反应为Na2O2+H2CO3=H2O2+2Na2CO3、2H2O2=2H2O+O2↑,
故答案为:Na2O2+H2CO3=H2O2+2Na2CO3、2H2O2=2H2O+O2↑;
(3)①Cu失去电子,被过氧化氢氧化,Cu溶解的离子反应为Cu+2H++H2O2═Cu2++2H2O,故答案为:Cu+2H++H2O2═Cu2++2H2O;
②CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,Cu元素的化合价降低,则S元素的化合价升高,发生2Cu2++2Cl-+SO32-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+可知,该反应中氧化产物和还原产物物质的量之比为1:2,
故答案为:1:2;
③a升高温度,反应速率加快,①中“加热”的目的是:加快反应的速率,由于硫酸铜溶液为蓝色,而[CuCl3]2-为无色溶液,当观察到溶液由蓝色变为无色现象,即表明反应已经完全,
故答案为:加快反应的速率; 溶液由蓝色变为无色;
b潮湿的CuCl在空气中易发生水解和氧化,开始加入的浓盐酸及用酒精洗涤均可以抑制水解,在真空中干燥,不能与空气接触,防止氧化,
故答案为:浓盐酸、95%乙醇、真空干燥.
点评 本题考查化学用语、氧化还原反应计算、工艺流程的理解、对操作与试剂的分析评价等,为高频考点,把握反应中元素的化合价变化及工艺流程原理为解答关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
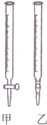 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | C点:c(Na+)=c(HA-)+2c(OH-) | |
| D. | 水电离出来得c(OH-):B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
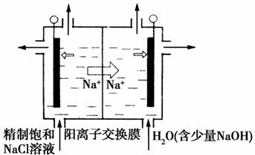 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
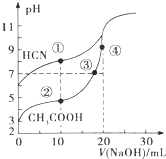
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com