
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
【答案】 2Al+ 3Cu2+ = 2Al3+ + 3Cu ![]() Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快(其它合理答案均给分) 假设二:Cl-对Al与Cu2+的置换反应存在促进作用 0.02mol 对照实验,排除Na+的干扰,证明Na+对该反应不造成影响; SO42-对Al与Cu2+的置换反应没有抑制作用 Cl-对Al与Cu2+的置换反应存在促进作用 用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈(其它合理答案均给分)
Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快(其它合理答案均给分) 假设二:Cl-对Al与Cu2+的置换反应存在促进作用 0.02mol 对照实验,排除Na+的干扰,证明Na+对该反应不造成影响; SO42-对Al与Cu2+的置换反应没有抑制作用 Cl-对Al与Cu2+的置换反应存在促进作用 用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈(其它合理答案均给分)
【解析】(1)①因Al比Cu活泼,实验Ⅰ中生成的红色物质应为Cu,发生反应的离子方程式为2Al+ 3Cu2+ = 2Al3+ + 3Cu;
②Cu2+的水解,使得溶液中存在H+的,水解反应离子方程式为Cu2++2H2O![]() Cu(OH)2+2H+;
Cu(OH)2+2H+;
③结合影响反应速率的因素可知,60s后Al与置换出的Cu在酸性条件下形成原电池或反应放热,温度升高速率加快均能使反应加快;
(2)根据实验现象可知,如果存在SO42-对Al与Cu2+的置换反应存在一定的抑制作用,则同样有Cl-对Al与Cu2+的置换反应存在促进作用的可能;
(3)为保证反应前溶液中Cl-浓度相等,实验Ⅵ应添加0.2molNH4Cl固体;设计实验Ⅵ的目的是通过对照实验,排除Na+的干扰,证明Na+对该反应不造成影响;其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:SO42-对Al与Cu2+的置换反应没有抑制作用;实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:Cl-对Al与Cu2+的置换反应存在促进作用;
(4)用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈,即可说明Cl-对Al与H+的反应同样起到相似的作用。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质,请将正确的序号填写在空格上。
①金刚石与“足球烯”C60; ②HCHO和CH3CHO; ③CH3CH2OH和CH3OCH3;④CH4和CH3CH2CH3;⑤D与T ; ⑥CH2=CH—CH2—CH3和CH3—CH=CH—CH3;⑦氧气(O2)与臭氧(O3)
同位素_________________;同系物_____________ ;
同素异形体_____________;同分异构体______________。
(2)现有下列六种有机物a.乙烷 b.乙烯 c.苯 d.乙醇 e.乙酸 f.CH2===CH—COOH g.CH2OH(CHOH)4CHO h.乙酸乙酯
①能与Na和NaOH溶液都反应的是_____________。
②分子内所有原子一定在同一平面上的有___________。
③常温下可能与溴水发生加成反应的有_____________。
④在一定条件下能发生酯化反应的有_______________。
⑤能与新制Cu(OH)2悬浊液反应的有________________。
⑥能发生水解反应的有______________。
(3)现有 A:CH3CH2OH; B:CH2OH—CH2OH;
C:CH2OH—CH(OH)—CH2OH三种有机物:
①等物质的量的这三种有机物完全燃烧耗氧量之比为______________;
②写出A与金属钠反应的化学方程式:_____________________________。
③等物质的量的这三种有机物与足量金属钠反应,同温同压下产生氢气的体积比为:__________________________。
④写出B在铜作催化剂的条件下与氧气反应的方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是( )
A. 因为河虾中含有砷元素,所以不能食用
B. “两者同食”发生的反应中维生素C作氧化剂
C. 五价砷在维生素C作用下发生了还原反应
D. 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在提纯混有少量氯化钾的硝酸钾时,第一步操作应
A.在常温下将混合物溶于水中形成浓溶液
B.在常温下将混合物溶于水中形成稀溶液
C.在较高温度下将混合物溶于水中形成浓溶液
D.在较高温度下将混合物溶于水中形成稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为__________________________________。
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下实验方案。
(1)实验原理。
AlN溶于浓的强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程_________。
(2)实验装置。

如图C装置中球形干燥管的作用是_________________________。
(3)实验过程。
①连接好实验装置________,然后称得C装置的质量为yg。
②称取xg AlN样品置于A装置中;塞好胶塞,关闭________打开________(填“K1”或“K2”);通过分液漏斗加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,称得C装置的质量变为zg,通入氮气的目的是__________________,装置B的作用是__________________________。
(4)数据分析。
①AlN的质量分数为________。(相对原子质量Al:27,N:14)
②由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示.
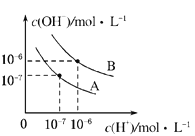
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02molL﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。含CN-废水在排放前的处理过程如下:

已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g/L的单质气体1.12L。
(1)溶液B具有性质_______________(填“氧化性”或“还原性”)。
(2)写出沉淀D在氧气中灼烧发生的化学方程式___________________________________。
(3)滤液C中还含有微量的CN-离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com