
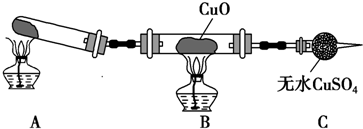
分析 (1)实验室用氯化铵和消石灰反应制备氨气,二者在加热条件下反应生成氨气、氯化钙和水;
(2)氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(3)①CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,以此书写化学方程式;
②依据氧化亚铜在酸溶液中发生自身氧化还原反应生成铜和铜离子,溶液蓝色证明氧化亚铜的存在;
③氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥.
解答 解:(1)实验室用氯化铵和消石灰反应制备氨气,二者在加热条件下反应生成氨气、氯化钙和水,反应的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(3)①CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
②Cu20是一种碱性氧化物,在酸性溶液中Cu+生成Cu+Cu2+,据此反应设计实验验证是否含有氧化亚铜,步骤为:取少量样品,加入稀硫酸,若溶液出现蓝色,说明含有Cu2O,否则不含有;
故答案为:取少量样品,加入稀硫酸,若溶液出现蓝色,说明含有Cu2O,否则不含有;
③氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气,装置图为: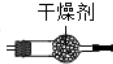 ,干燥剂为碱石灰;
,干燥剂为碱石灰;
故答案为:氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥; ,干燥剂碱石灰.
,干燥剂碱石灰.
点评 本题考查了氨气实验室制备和性质检验,明确氨气制备原理及氨气的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
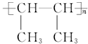 .
.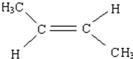 .
.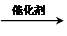 CH2=CH2+(CH3)2C=C(CH3)2.
CH2=CH2+(CH3)2C=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据图回答下列问题:
某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据图回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 熔、沸点HF>HCl>HBr | ||
| C. | 熔、沸点KCl<MgO<MCl2 | D. | 熔、沸点CH4<SiH4<GeH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 丁达尔效应可以区分胶体与溶液 | |
| C. | 化合物氯化钾灼烧透过蓝色钴玻璃片观察为紫色 | |
| D. | 检验氨气是否集满,用湿润的红色石蕊试纸放在集气瓶口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com