
 实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: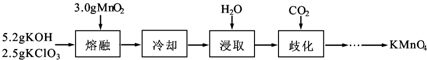
分析 (1)从瓷坩埚原料含有SiO2,高温下与KOH发生反应进行分析;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,根据氧化还原反应可知,还生成KCl,由元素守恒可知,还会生成H2O;
MnO2存在,高温下KClO3可能发生分解反应生成氯化钾与氧气;
(3)①依据氧化还原反应原理书写离子反应方程式即可;
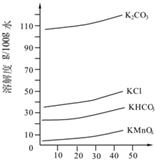
②由溶解度曲线可知,KHCO3的溶解度较小,过量的二氧化碳会生成碳酸氢钾,与高锰酸钾同时析出,据此解答即可;
③高锰酸钾为紫红色溶液,据此解答即可;
④依据从溶液中得到固体的方法回答即可;
(4)熔融过程中加入二氧化锰,歧化反应中生成二氧化锰,据此解答.
解答 解:(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,故答案为:在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,根据氧化还原反应可知,还生成KCl,由元素守恒可知,还会生成H2O,反应方程式为KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$KCl+3K2MnO4+3H2O,故答案为:KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$KCl+3K2MnO4+3H2O;
(3)①此反应中锰酸钾既作氧化剂又作氧化剂,发生歧化反应,+6价的Mn部分升高为+7价,部分降低为+4价,碱性溶液中二氧化碳变为碳酸根,故方程式为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,故答案为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;
②由溶解度曲线可知,KHCO3的溶解度较小,过量的二氧化碳会生成碳酸氢钾,与高锰酸钾同时析出,对高锰酸钾的制取造成干扰,故答案为:二氧化碳过量会生成溶解度比K2CO3小得多的KHCO3,可能与KMnO4同时析出;
③若有高锰酸钾生成,溶液应显示紫红色,故取少许溶液于滤纸上,若观察到紫色,说明有高锰酸钾产生,故答案为:滤纸上有紫红色;
④从溶液中得到固体,需经过过滤、加热浓缩、趁热过滤、干燥等操作,故答案为:加热浓缩、趁热过滤;
(4)从整个制取流程可以看出熔融过程中加入二氧化锰固体,在通入二氧化碳的歧化反应中又生成,据此得出二氧化锰固体可以循环利用,故答案为:MnO2.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应、工艺条件的控制等,难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


科目:高中化学 来源: 题型:选择题

| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H20 | |
| B. | 碳酸钠溶液与少量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| D. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
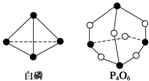 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用澄清的石灰水鉴别SO2和CO2 | |
| B. | SO2能使溴水、KMnO4溶液迅速褪色 | |
| C. | 硫粉在过量的氧气中燃烧可得到SO3 | |
| D. | 少量SO2通入到浓的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com