
| A、单位时间内生成n mol A2,同时生成n mol B2 | B、单位时间内生成2n mol AB,同时生成n mol B2 | C、容器内总压强不随时间改变 | D、容器内物质的总质量保持不变 |


科目:高中化学 来源: 题型:
Br2(g)+H2(g) ![]() 2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
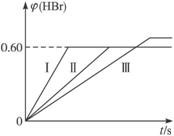
(1)达平衡时,用Br2(g)表示的化学反应速率是_____________。
(2)若改变反应条件,在甲条件下φ(HBr)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HBr)的变化如图中曲线(Ⅲ)所示,则甲条件可能是(填入下列条件的序号,下同)___________,乙条件可能是___________。
A.恒温条件下,缩小反应容器体积
B.恒温条件下,扩大反应容器体积
C.恒容条件下,升高温度
D.恒容条件下,降低温度
E.恒温、恒容条件下,加入适当催化剂
F.恒温、恒容时充入氩气
(3)若保持温度不变,在另一相同的
查看答案和解析>>
科目:高中化学 来源:山东省月考题 题型:填空题
 CO2(g)+H2(g)
CO2(g)+H2(g)  H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
H=-41.16kJ/mol 对于该反应有关表述正确的是________________。  H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。 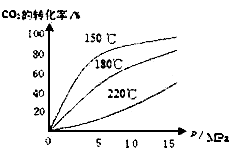
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
 CO2(g)+H2(g)
CO2(g)+H2(g)  H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
H=-41.16kJ/mol 对于该反应有关表述正确的是________________。  H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。 
查看答案和解析>>
科目:高中化学 来源: 题型:
将2mol I2(g)和1mol H2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)![]() 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时
如图曲线(Ⅱ)所示。

(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(Ⅰ)所示,在乙条件下ω(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com