
【题目】CrO42-和Cr2O72-在溶液中可相互转化。室温下,1.0×10-3mol/L的Na2CrO4溶液中c(Cr2O72-)随pH的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的可逆反应________________。
(2)调节该溶液的酸碱性使pH减小,观察到实验现象为_______________根据图示中A点数据,计算出该转化反应的平衡常数________;
(3)温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“大于”、“等于”或“小于”)。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定待测液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,作为滴定终点标志。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为____ mol/L,此时溶液中c(CrO42-)等于____ mol/L。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【答案】2CrO42- + 2H+ ![]() Cr2O72-+ H2O 溶液由黄色变为橙色 1.0×10-5L3/mol3 小于 2.0×10-5 5.0×10-3
Cr2O72-+ H2O 溶液由黄色变为橙色 1.0×10-5L3/mol3 小于 2.0×10-5 5.0×10-3
【解析】
(1)随着H+浓度的增大,CrO42转化为Cr2O72的离子反应式为:2CrO42+2H+Cr2O72+H2O,
故答案为:2CrO42+2H+Cr2O72+H2O;
②溶液酸性增大,平衡2CrO42+2H+Cr2O72+H2O正向进行,CrO42的平衡转化率增大,平衡正向移动,溶液由黄色变为橙色;A点Cr2O72的浓度为0.25×10-3mol/L,pH=1,H+浓度为1×101mol/L,则消耗的CrO42的浓度为0.5×10-3mol/L,则溶液中的c(CrO42)=1.0×10-3mol/L0.25×10-3mol/L×2=0.5×10-3mol/L,,此时该转化反应的平衡常数为K=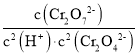 =
= =1.0×10-5L3/mol3,
=1.0×10-5L3/mol3,
故答案为:溶液由黄色变为橙色;1.0×10-5L3/mol3;
(3)升高温度,溶液中CrO42的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:小于;
(2)当溶液中Cl完全沉淀时,即c(Cl)=1.0×105mol/L,依据Ksp(AgCl)=2.0×1010,计算得到c(Ag+)= =
=![]() =2.0×105mol/L,
=2.0×105mol/L,
此时溶液中c(CrO42)= =
= =5.0×103mol/L,
=5.0×103mol/L,
故答案为:2.0×105;5.0×103。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.0.1mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强
B.适当升高温度,CH3COOH溶液pH增大
C.稀释0.1 mol/L NaOH溶液,水的电离程度减小
D.CH3COONa溶液中加入少量CH3COOH,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
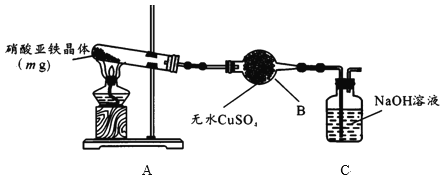
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
实验 | 装置 | 试剂x | 操作及现象 |
Ⅰ |
| 1 mol·L1 CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
Ⅱ | 1 mol·L1 CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
已知:Ⅰ.Cu2+![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+![]() [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______,反应的离子方程式为_______。
(2)对实验 Ⅰ 产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
① 假设a不合理,实验证据是_______;
② 实验表明假设b合理,实验I反应的离子方程式有_____、H+ + HSO3- = SO2↑+H2O。
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______(补全实验操作及现象)。

(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: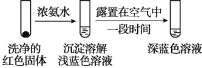
证实红色沉淀中含有Cu+的实验证据是_______;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 39gNa2O2与CO2完全反应,转移的电子数为![]()
B. 6.0gNO和3.2gO2混合,所得气体的分子数目为0.2![]()
C. 84gFe完全转化为Fe3O4,失去的电子数为4![]()
D. 1molCu和2mol热浓硫酸反应,生成SO2分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃,每100g水仅能溶解0.148gCa(OH)2。CaCO3在水中达到溶解平衡时,其Ksp为8.0×10-9(溶液密度近似为1g/cm3)。
(1)计算20℃时Ca(OH)2饱和溶液中的c(OH-);_________
(2)在10 mL Ca(OH)2饱和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液体积变化,通过计算判断是否生成CaCO3沉淀_________,并求此时溶液中c(Ca2+)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧
B.H2SO4与Cu反应
C.二氧化硫通入澄清石灰水
D.硫酸中加入锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 分子结构的下列叙述中正确的是
分子结构的下列叙述中正确的是
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如右图所示,X原子最外层有5个电子。下列说法正确的是

A.离子半径:W< Z2B.还原性:Z2<W
C.酸性:H3YO4 >HXO3D.氢化物的稳定性:YH3> H2Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com