
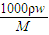 计算该盐酸的物质的量浓度;
计算该盐酸的物质的量浓度;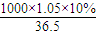 mol/L=2.88mol/L,
mol/L=2.88mol/L, =6.45L
=6.45L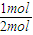 =0.288mol,
=0.288mol,

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省聊城市某重点中学高一第四次模块检测化学试卷(带解析) 题型:计算题
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高一第四次模块检测化学试卷(解析版) 题型:计算题
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
查看答案和解析>>
科目:高中化学 来源:2015届四川省高一上学期期中考试化学试卷(解析版) 题型:计算题
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com