
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请回答下列问题:
(1)实验室制取氯气的反应原理为:MnO2+4HCl(浓)  MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①该反应中被还原的元素是 ,还原剂是 。
②取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积为33.6 L,则被氧化的HCl的物质的量为 ,反应中转移电子数为 。
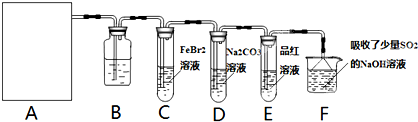
(2)某同学用下列装置制备并检验Cl2的性质。


下列说法正确的是
a.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
b.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
c.Ⅲ图中:生成蓝色的烟
(3)若氯气罐发生泄漏,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 。
a.NaOH b.NaCl c. KOH d. Na2CO3
(4)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是 。
将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是 (填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
(12分)(1)①Mn (1分) HCl(1分)
②3mol (1分) 3NA或1.806×1024(2分)
(2)b(2分)
(3)d(1分)
(4)SO2(1分);BaCl2(1分)。SO2+C12+2H2O=4H++SO42-+2Cl-(2分)
【解析】
试题分析:(1)①化合价升高,被氧化,做还原剂;化合价降低,被还原,做氧化剂;故该反应中被还原的元素是Mn,还原剂是HCl。
②氯气的物质的量为33.6L÷22.4L/mol=1.5mol。化学方程式中的4HCl(浓)被氧化的只是一般,即被氧化的HCl的物质的量为3mol,反应中转移电子数为3NA。
(2)a、盐酸的浓度随着反应逐渐变稀,稀到一定程度就不反应了,故错;c、生成的是棕黄色的烟,故错。故选b。
(3)a和c、碱性强,有腐蚀性,故错;b、与氯气反应不大,故错。故选d。
(4)SO2和Cl2都有漂白性,但漂白原理不同,Cl2具有强氧化性,漂白后不可逆转,而SO2与有色物质结合生成无色物质,漂白后可逆转。故试管通入的气体是SO2。
SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,发生了氧化还原反应,离子方程式为SO2+C12+2H2O=4H++SO42-+2Cl-。检验选用BaCl2,如有沉淀就发生了反应。
考点:氧化还原反应 氯气的制备、性质及反应
点评:本题考查的是氧化还原反应和氯气的制备、性质及反应的知识,题目难度中,考查学生对基础知识点的掌握以及分析问题、解决问题的能力。


科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com