
【题目】已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为生活中用途最广泛的金属单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
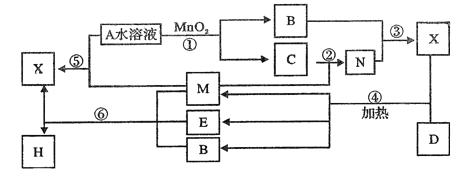
(1)A的结构式_________________,E的化学式为______________。
(2)在①至⑥的化学反应中,属于非氧化还原反应的化合反应为(填序号)__________________。
(3)写出下列反应的化学方程式②_______________,④________________。
(4)写出⑥的离子方程式:_____________________。
(5)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,所得沉淀经过滤、洗涤、灼烧至恒重,称量所得固体的质量为___________________。
【答案】(1)H-O-O-H ;Fe2(SO4)3(2)③
(3)2 SO2+O2![]() 2SO3;2 Fe+6H2SO4(浓)
2SO3;2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(4)2Fe3++2H2O+SO2=SO42-+2Fe2++4H+(5)32g
【解析】
试题分析:A、B均为液体,且组成相同,可能是H2O和H2O2,H2O2在MnO2催化下可分解生成水和O2,故A为H2O2,B为H2O,C为O2;固体单质D与X的浓溶液在常温下不反应,加热时反应生成M、E和H2O,M能与O2反应,D与E溶液能够发生化合反应,且反应前后溶液颜色有变化,则D为Fe,M为SO2,E为Fe2(SO4)3,N为SO3,X为H2SO4。
(1)A为H2O2,结构式为H-O-O-H,E为Fe2(SO4)3,故答案为:H-O-O-H ;Fe2(SO4)3;
(2)在①至⑥的化学反应中,属于非氧化还原反应的化合反应为③,故答案为:③;
(3)反应②二氧化硫的催化氧化,反应的化学方程式为2 SO2+O2![]() 2SO3,反应④铁和浓硫酸的反应,反应的化学方程式为2 Fe+6H2SO4(浓)
2SO3,反应④铁和浓硫酸的反应,反应的化学方程式为2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,故答案为:2SO2+O2
Fe2(SO4)3+3SO2↑+6H2O,故答案为:2SO2+O2![]() 2SO3;2 Fe+6H2SO4(浓)
2SO3;2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;
Fe2(SO4)3+3SO2↑+6H2O;
(4)反应⑥为Fe2(SO4)3氧化二氧化硫的反应,反应的离子方程式为2Fe3++2H2O+SO2=SO42-+2Fe2++4H+,故答案为:2Fe3++2H2O+SO2=SO42-+2Fe2++4H+;
(5)H为FeSO4,通入氧气,生成红褐色沉淀且溶液呈棕黄色,最后得到Fe(OH)3和Fe2(SO4)3,由质量守恒可知1.2molFeSO4可生成0.4molFe(OH)3和0.4molFe2(SO4)3,0.4molFe(OH)3灼烧分解可得到0.2molFe2O3,质量为0.2mol×160g/mol=32g,故答案为:32g。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,正确的组合是( )
选项 | 甲 | 乙、丙、丁 |
A | 纯净物 | 液氯、水玻璃、明矾 |
B | 非电解质 | 冰醋酸、SO2、乙醇 |
C | 弱电解质 | CH3COOH 、氨水、H2O |
D | 碱性氧化物 | CaO、Na2O、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质所选用的除杂质试剂与主要分离方法都正确的是(括号内为少量杂质),
不纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | 乙酸乙酯(乙酸) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓Br2水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成分是SiO2
D.电解熔融MgCl2,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量 用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与 氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 B的结构简式
(2)A使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型: ;
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,
反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
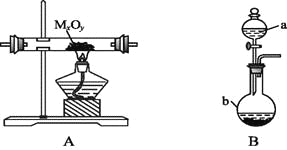
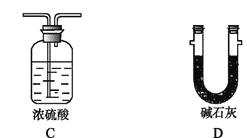
(1)仪器a的名称为 ,仪器b中装入的试剂可以是 。
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用): 。
(3)装置C的作用: 。
(4)实验结束时,应首先 (填序号); 这样做的原因是 。
Ⅰ.熄灭A装置的酒精灯 Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为 。
(6)若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为 (用含x、y、m、n的式子表示)。
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.①![]() H与
H与![]() H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷![]() ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______ (填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。
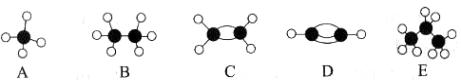
(1)D的电子式为___________,A的二氯取代物有 种。
(2)可作为植物生长调节剂的是 (填结构简式);
(3)A与氯气反应可以生成多种物质,试任写其中一个反应的化学方程式: ;
(4)C与水在一定条件下反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜能被FeCl3的浓溶液腐蚀,其化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2。
现将有铜的印刷线路板浸入120mL FeCl3的溶液中,有9.6 g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。(设溶液体积不变,且不考虑金属离子水解)。
(1)根据9.6g铜被腐蚀,最后溶液中还有4.8g不溶物,说明溶液中肯定还有_____,所以4.8g固体不可能有____,即4.8g是_______。
(2)9.6 g铜被腐蚀生成________ mol Fe2+。
(3)最后溶液中金属离子物质的量浓度c(Cu2+)=______,c(Fe2+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com