
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A、四种溶液中,水的电离程度①>②>④>③ |
| B、Na2CO3和NaHCO3溶液中,粒子种类相同 |
| C、将等浓度的CH3COOH和HClO溶液,pH小的是HClO |
| D、Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
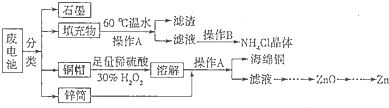

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应:O22-+2H2O═2OH-+H2↑ | ||||
| B、用纯碱溶液溶解苯酚:CO32-+2C6H5OH═2C6H5O-+CO2↑+H2O | ||||
C、用石墨作电极电解AlCl3溶液:2Cl-+2H2O
| ||||
| D、将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向卤代烃加硝酸酸化的硝酸银来检验其中的卤族元素 |
| B、实验用NH4Cl固体受热分解来制备NH3 |
| C、用盐酸和澄清石灰水来检验某物质是否含有CO32- |
D、可用如图所示的装置和药品来研究反应物浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH 溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH═BaSO4↓+2NH3?H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(s)+CO2(g)?2CO(g) (正反应为吸热反应) |
| B、3O2(g)?2O3(g) (正反应为吸热反应) |
| C、CO(g)+NO2(g)?CO2(g)+NO(g) (正反应为放热反应) |
| D、N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、SO32-、Cl- |
| B、MnO4-、SO42-、K+、H+ |
| C、Al3+、Mg2+、NO3-、HCO3- |
| D、Fe3+、Na+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2种 | B、4种 | C、6种 | D、8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
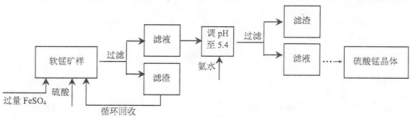
| 沉淀物 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| pH | 3.7 | 9.8 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com