
| A. | 6 | B. | 7 | C. | 9 | D. | 10 |
分析 加热时NaHCO3和Na2CO3•xH2O发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=$\frac{21.2g}{106g/mol}$=0.2mol,除去碳酸氢钠得到的就是Na2CO3•xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3•xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=$\frac{12.6g}{18g/mol}$=0.7mol,根据Na2CO3•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,从而确定x值.
解答 解:加热时NaHCO3和Na2CO3•xH2O发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=$\frac{21.2g}{106g/mol}$=0.2mol,除去碳酸氢钠得到的就是Na2CO3•xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3•xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=$\frac{12.6g}{18g/mol}$=0.7mol,根据Na2CO3•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,0.1xmol=0.7mol,x=7,
故选B.
点评 本题考查混合物计算、根据反应原理进行计算等,清楚发生反应是解题关键,难度中等.


科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
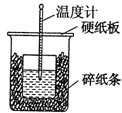 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.6 |
| 2 | 20.3 | 20.3 | 23.7 |
| 3 | 20.3 | 20.3 | 25.9 |
| 4 | 20.3 | 20.3 | 23.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
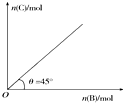 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )| A. | 降低温度,则图中θ>45° | |
| B. | 平衡后再加入B,正反应速率增大,逆反应速率减小 | |
| C. | 平衡时B的转化率为50% | |
| D. | 平衡后再加入A,体系内气体密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除去杂质所用的试剂和方法 |
| A | 碳酸钠粉末 | 碳酸钙粉末 | 加足量水过滤、蒸发 |
| B | 二氧化碳 | 氧气 | 点燃混合气体 |
| C | 铁 | 氧化铁 | 加足量盐酸蒸发 |
| D | 氯化铁溶液 | 氯化铜 | 加足量铁粉过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
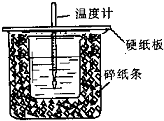 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com