
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置:(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为 。
(2)铜片周围溶液会出现 的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2g,计算导线中流过的电子的物质的量为 mo1。
(1)Fe -2e-= Fe2+ (2)溶液颜色变浅 (3)0.02
解析试题分析:(1)Fe、Cu及硫酸铜溶液构成了原电池,由于活动性Fe>Cu,所以Fe作负极,发生反应Fe-2e-= Fe2+。(2)由于Cu2+不断在铜片上放电,Cu2++2e-=Cu。所以铜片周围溶液中Cu2+的浓度降低,溶液的颜色会出现变浅。(3)总反应方程式是Fe+Cu2+=Fe2++Cu。可见每有2mol的电子转移,在铁片和铜片之间的质量差56g+64g=120g,现在质量差值为1.2g,,所以电子转移(1.2g÷120g)×2=0.02mol..
考点:考查原电池反应原理、相应的现象及电子转移的知识。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL: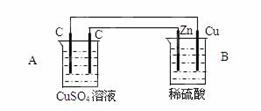
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,
电极反应式为 ;
A池中总反应化学方程式为 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(27分)(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。
② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L-1CuSO4溶液,如有0.20 mol电子发生转移,请回答下列问题:
(1)阴极发生 反应,
电极反应式为 ;
(2)阳极发生 反应,
电极反应式为 ;
(3)电解后得到的铜的质量是 ,得到氧气的体积是 (标准状况),溶液的pH是 ;
(4)如果用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的pH 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg 、Al | 稀盐酸 | 偏向Al |
| ② | Al、Cu | 稀盐酸 | 偏向Cu |
| ③ | Al、石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg、Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
AgNO3—HNO3溶液
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是___________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解NO3-的原理如图所示。
电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com