
| c(N2) |
| c2(H2)?c2(NO) |
| 0.2 |
| 0.12×0.12 |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
A、甲醛的电子式: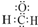 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
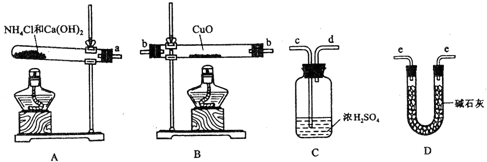
查看答案和解析>>
科目:高中化学 来源: 题型:
A、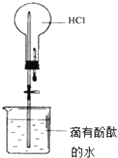 打开止水夹,烧瓶内出现红色喷泉 |
B、 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、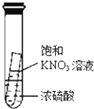 静置一段时间,小试管内有晶体析出 |
D、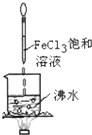 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
| B、浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
| ||
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱式碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
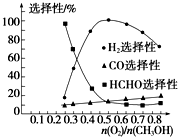
| n(O2) |
| n(CH3OH) |
| n(O2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、mol/L |
| B、mol/L |
| C、2.5dmol/L |
| D、1.25dmol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com