
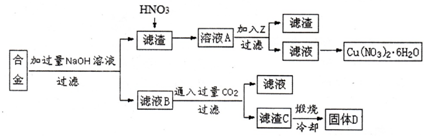
分析 含有铝、铁、铜的废弃合金加入过量氢氧化钠溶液过滤得到滤渣B为Cu、Fe,滤液为NaAlO2溶液,通入过量的二氧化碳生成氢氧化铝和碳酸氢钠溶液;滤渣中加入X生成Y和溶液A,Y通入氧气反应生成X,判断X为HNO3,Y为NO气体,溶液A为Fe(NO3)3,Cu(NO3)2,加入Z调节溶液PH使铁离子沉淀得到滤渣E为Fe(OH)3,滤液通过蒸发浓缩,冷却结晶,过滤洗涤得到硝酸铜晶体;
(1)合金中只有铝与加入NaOH溶液反应生成偏铝酸钠和氢气;
(2)滤液B为NaAlO2溶液,通入过量C02生成氢氧化铝和碳酸氢钠;
(3)铁离子完全沉淀,而铜离子不能沉淀,所以PH控制在3.2≤pH<4.7,除杂不能引入新的杂质;
(4)为了测定硝酸铜晶体的结晶水含量,获得硝酸铜晶体后要结过冷却、恒重操作再进行称量样品、加热、称量CuO质量、计算;
(5)根据差量计量氢氧化铝的质量,然后根据质量分数为:$\frac{氢氧化铝的质量}{滤渣的总质量}$×100%计算;
(6)可能是碳酸氢钠的溶解度小而析出到滤渣中,或者烘干不到位的因素造成.
解答 解:(1)合金中只有铝与加入NaOH溶液反应,所以离子方程式为:2Al+2OH-+2H2O→2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O→2AlO2-+3H2↑;
(2)滤液B为NaAlO2溶液,通入过量C02生成氢氧化铝和碳酸氢钠,反应的离子方程式为NaAlO2+CO2+2H2O→Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O→Al(OH)3↓+NaHCO3;
(3)铁离子完全沉淀,而铜离子不能沉淀,所以PH控制在3.2≤pH<4.7,除杂不能引入新的杂质,加入铜粉将铁离子还原成亚铁离子,而氨水引入铵根离子,硝酸铜溶液起不到调节PH的作用,所以只能用氧化铜,
故答案为:3.2≤pH<4.7;c;
(4)为了测定硝酸铜晶体的结晶水含量,获得硝酸铜晶体后要结过冷却、恒重操作再进行称量样品、加热、称量CuO质量、计算,
故答案为:冷却、恒重操作;
(5)由2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O可知水的质量为:(10.0-6.9)g=3.1g,所以氢氧化铝的质量为:$\frac{78×2}{3×18}$×3.1g=8.96g,所以质量分数为:$\frac{8.96g}{10.0g}$×100%=89.56%,
故答案为:89.56%;
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能是滤渣C没有洗涤,混有NaHCO3,滤渣C洗涤后未烘干或烘干不达标,
故答案为:滤渣C没有洗涤,混有NaHCO3,煅烧后失重偏大;滤渣C洗涤后未烘干或烘干不达标,混有微量水,煅烧后失重偏大.
点评 本题考查了物质分离提纯的方法分析,流程理解应用,掌握基础,实验基本操作是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾(K2SO4) | 0.25 | 174 |
| 高锰酸钾(KMnO4) | 0.25 | 158 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 硝酸银(AgNO3) | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C12H22O11属于二糖 | |
| B. | 化合物X属于还原型糖 | |
| C. | 反应③中1mol化合物X分解成3mol乙醇 | |
| D. | 欲使发酵液中的酒精和水初步分离,可采取的操作是蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是Al2O3 | B. | 依次为AlCl3、Al2(SO4)3 | ||
| C. | 都是Al(OH)3 | D. | 依次为Al2O3、Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;画出碳原子结构示意图
;画出碳原子结构示意图 ;氧元素位于周期表第周期第VIA族.
;氧元素位于周期表第周期第VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
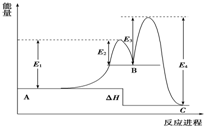 某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 三种化合物中C最稳定 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 整个反应的△H=E1-E 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入NO2,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶 | |
| C. | 碳酸钙不溶于水,只有在熔融状态下才是强电解质 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com