
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、电解MgCl2饱和溶液,可制得金属镁 |


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、提取碘水中的碘可采用加入四氯化碳后再分液的方法 |
| B、钨丝用于灯泡主要是因为钨的熔点很高 |
| C、胶体区别于其他分散系的本质特征是胶体能产生丁达尔现象 |
| D、生铁和钢的熔点都比纯铁低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②③④ |
| B、只有④⑤⑥ |
| C、只有①③⑤⑥ |
| D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
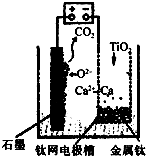 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )| A、该电池工作过程中O2-向阴极移动 |
| B、阳极的电极反应式为C+2O2--4e-═CO2↑ |
| C、若用铅蓄电池作该装置的供电电源,“-”接线柱应连接PbO2电极 |
| D、在制备金属钛前后,整套装置中CaO的总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由水电离的c(H+)=1×l0-12 mol?L-1的溶液中:Ba2+、K+、Cl-、NO
| ||||
B、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO
| ||||
C、无色溶液中:K+、Na+、MnO
| ||||
D、含有大量HCO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O |
| B、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、在硅酸钠溶液中滴加稀硫酸SiO32-+2H+=H2SO3↓ |
| D、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com