
(1)在亚磷酸溶液中加入过量的氢氧化钠溶液,生成的主要产物是Na2HPO3。这一事实证明亚磷酸是几元酸。推断它的结构式。
(2)亚磷酸溶液中加入AgNO3溶液后,有黑色沉淀生成并且生成无色气体,试管口有红棕色气体产生,写出有关化学反应方程式。
(3)亚磷酸具有强还原性,当它与碘水混合后,可以看到碘水的棕黄色褪去,并有H3PO4生成,写出有关化学反应方程式。

(2)AgNO3+2H3PO3====Ag↓+NO↑+2H3PO4。
(3)I2+H3PO3+H2O====H3PO4+2HI。
解析:(1)在NaOH过量时产物为Na2HPO3,说明其中有两个氢电离后被中和,因此H3PO3为二元酸。
(2)题目已较明显地指出了反应产物有无色的NO(进一步氧化为红棕色气体NO2),同时生成了黑色沉淀为Ag,该过程中H3PO3被氧化成H3PO4。其反应方程式为AgNO3+2H3PO3====Ag↓+NO↑+2H3PO4。
(3)根据题中的有关信息可分析出:I2氧化了有强还原性的H3PO3,生成了H3PO4,其反应方程式为:H3PO3+I2+H2O====H3PO4+2HI。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
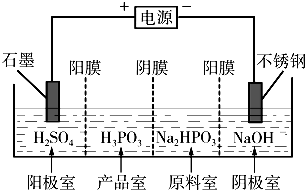 (2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |
 |
 |
| 非羟基 氧原子数 |
0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |




查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com